IZOLACE DNA Z ŽIVOČIŠNÝCH TKÁNÍ POUŽITÍM FENOL-CHLOROFORMU
Při izolaci genomové DNA pomocí fenol-chloroformu postupujeme v těchto krocích:
• Homogenizace, tj. rozrušení tkáně – nejlépe v tekutém dusíku a porcelánových miskách, případně tloučkem přímo ve zkumavce v lyzačním roztoku
• Rozrušení buněk buněčnou lyzí a natrávení proteinů
• Separace DNA od proteinů a dalších příměsí pomocí fenol-chloroformu
• Získání roztoku DNA
• Kontrola integrity izolované DNA elektroforetickou separací (měl by být patrný celistvý proužek vysokomolekulární DNA)
• Stanovení koncentrace DNA v roztoku DNA
——————————————————————————————————————————-——————————————————————————————————————————-
1. HOMOGENIZACE (ROZMĚLNĚNÍ) TKÁNĚ V TEKUTÉM DUSÍKU
Tkáň nejlépe homogenizujeme pomocí tekutého dusíku v porcelánových třecích miskách. V některých případech můžeme vzorek homogenizovat i jednodušším způsobem, i když mnohem méně efektivně, tj. přímo ve zkumavce v připraveném lyzačním roztoku s použitím plastového tloučku.
Homogenizace tkáně v tekutém dusíku
• Tekutým dusíkem misky i tloučky nejprve vychladíme tak, že dusík nalijeme do misky a postupně ho přiléváme až do řádného zchlazení misky, při kterém již nebude docházet k výraznému odpařování dusíku.
• K dusíku v misce přidáme tkáň a pomocí tloučku ji rozmělníme na jemný prášek. Získaný prášek vychlazenou kopistkou či lžičkou přeneseme do zkumavky s extrakčním pufrem. Objem extrakčního pufru se obvykle pohybuje kolem 500 μl na 100 mg tkáně, ale samozřejmě také závisí na typu tkáně (je třeba určit empiricky). Složení extrakčního roztoku je uvedeno v tabulce.
• Roztok inkubujeme ve zkumavce v horizontální poloze při 37 °C 2 – 12 hod, přičemž zvolna promícháváme.
![]() Abychom zamezili nukleolytickému štěpení DNA, s rozmělněným materiálem pracujeme rychle, nenecháme jej roztát, a co nejdříve jej přeneseme do extrakčního pufru. Rovněž při práci s tekutým dusíkem používáme ochranné pomůcky, a to zejména rukavice, ochranné brýle a laboratorní plášť. Je třeba brát zřetel na to, že se třecí misky a tlouček působením tekutého dusíku stanou velmi podchlazenými, a proto při manipulaci s nimi využíváme ochranné pomůcky (např. látkové chňapky, utěrky).
Abychom zamezili nukleolytickému štěpení DNA, s rozmělněným materiálem pracujeme rychle, nenecháme jej roztát, a co nejdříve jej přeneseme do extrakčního pufru. Rovněž při práci s tekutým dusíkem používáme ochranné pomůcky, a to zejména rukavice, ochranné brýle a laboratorní plášť. Je třeba brát zřetel na to, že se třecí misky a tlouček působením tekutého dusíku stanou velmi podchlazenými, a proto při manipulaci s nimi využíváme ochranné pomůcky (např. látkové chňapky, utěrky).
Po započetí lýze vzorku v lyzačním roztoku manipulujeme s roztokem velmi jemně a opatrně, protože vlákna DNA, která se do roztoku uvolňují, jsou velmi náchylná na mechanické poškození. Opatrným zacházením zajistíme co nejlepší celistvost izolované DNA, která je třeba pro některé aplikace jako např. Southernův blot.
Složení extrakčního pufru (10 ml):
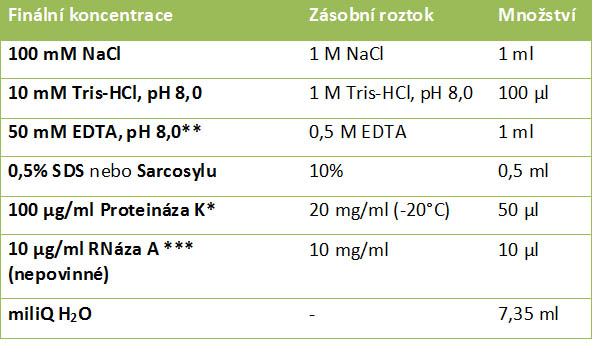
* do extrakčního roztoku se přidává až těsně před použitím
** koncentrace závisí na množství endogenních nukleáz ve vzorku. Podle toho se finální koncentrace může pohybovat od 25 – 100 mM (je třeba určit empiricky).
*** přidává se až v průběhu experimentu
![]() Pokud chcete z roztoku DNA odstranit také RNA, proveďte působení s RNázou A. Tzn. na závěr inkubace vzorku v lyzačním roztoku přidejte RNázu A v takovém množství, aby její finální koncentrace byla 10 mg/ml. Roztok inkubujte alespoň 15 min při 37 °C.
Pokud chcete z roztoku DNA odstranit také RNA, proveďte působení s RNázou A. Tzn. na závěr inkubace vzorku v lyzačním roztoku přidejte RNázu A v takovém množství, aby její finální koncentrace byla 10 mg/ml. Roztok inkubujte alespoň 15 min při 37 °C.
Vysvětlení ke složení lyzačního pufru najdete ZDE
——————————————————————————————————————————-——————————————————————————————————————————-
2. PURIFIKACE DNA OD PROTEINŮ
Při purifikaci roztoku DNA od proteinů se k získanému lyzátu postupně přidává fenol či směs fenolu a chloroformu, které z lyzátu proteiny odseparují. Přidáním těchto látek k vodnému roztoku dojte k rozdělení roztoku do dvou fází. Horní fáze je vodný roztok obsahující DNA, spodní je pak organická fáze fenolu či chloroformu. Mezi vodnou a organickou fází se hromadí proteiny. Detailnější informace o fenol-chloroformové extrakci najdete zde.
Při fenol-chloroformové extrakci postupujeme:
• Roztok s DNA necháme zchladnout na pokojovou teplotu, přidáme stejný objem fenolu jako je objem roztoku a zvolna promícháváme cca 15 – 30 min. Přidáním fenolu se vytvoří dvě fáze. Horní je roztok s DNA, spodní je vrstva fenolu.
![]() pH použitého fenolu musí být 8. Fenol určený pro izolaci DNA lze již přímo koupit nebo si ho lze v laboratoři připravit: Různé roztoky – LabGuide.cz (posunemevasvys.cz)
pH použitého fenolu musí být 8. Fenol určený pro izolaci DNA lze již přímo koupit nebo si ho lze v laboratoři připravit: Různé roztoky – LabGuide.cz (posunemevasvys.cz)
• Centrifugací (5000 g, 15 min, při pokojové teplotě) oddělíme tři vrstvy – horní roztok s DNA, prostřední vrstvu bílkovin a spodní vrstvu fenolu. Vrchní viskózní vodnou fázi, jež obsahuje DNA, opatrně a velmi zvolna odsajeme a přeneseme do nové zkumavky.
• Fenolovou extrakci s následnou centrifugací opakujeme dle potřeby 1 – 2x, a to podle velikosti vrstvy proteinů, která se centrifugací vytvoří. Rovněž doba inkubace s fenolem může být snížena či zvýšena.
• Podobným způsobem provedeme extrakci s fenol-chloroform-izoamylalkoholem (25:24:1) a poté chloroform-izoamylalkoholem (24:1). Počet extrakčních kroků závisí na vlastním uvážení podle velikosti vrstvy proteinů, které se nám centrifugací separují.
• Výsledkem fenol-chloroformové extrakce je roztok DNA přečištěný od proteinů. V následném kroku je třeba DNA separovat od dalších zbylých příměsí, a to pomocí její precipitace.
![]() Směs fenol-chloroform-izoamylalkoholu by měla být pokud možno průhledná. Pokud není, znamená to, že směs obsahuje vodu. Vodu lze odstranit centrifugací, při které se voda odseparuje jako vrchní fáze (5000 g, 6 min, při pokojové teplotě).
Směs fenol-chloroform-izoamylalkoholu by měla být pokud možno průhledná. Pokud není, znamená to, že směs obsahuje vodu. Vodu lze odstranit centrifugací, při které se voda odseparuje jako vrchní fáze (5000 g, 6 min, při pokojové teplotě).
Pro zvýšení celistvosti izolované DNA jsou doporučovány špičky s velkým průměrem okolo 3 mm (například nůžkami ustřižený konec). Rovněž při centrifugaci dbáme na nízkou akceleraci a deceleraci centrifugy! Celkově s roztokem DNA zacházíme šetrně, bez prudkých pohybů.
V roztoku, z něhož je DNA precipitována, nesmí být zbytky fenolu, které by mohly jednak narušit účinnost precipitace, a jednak by kontaminovaly výsledný roztok DNA. Aby bylo zajištěno, že v roztoku nezbude žádný fenol či chloroform, je doporučováno získaný roztok ještě jednou na závěr centrifugovat, do čisté zkumavky odebrat většinu roztoku opatrným pipetováním a to s tím, že na dně zkumavky je ponechán malý zbytek roztoku (s případnou fenol-chloroformovou kontaminací).
——————————————————————————————————————————-——————————————————————————————————————————-
4. PRECIPITACE DNA
Precipitací DNA se rozumí její vysrážení. Vysrážení DNA, tj. separaci DNA od vodného roztoku, je docíleno přídavkem vhodných látek.
• Pro precipitaci přidáme 1/10 objemu 3 M Na-acetátu (pH 5,2) a 2,5x objem 100% etanolu a promícháme jemným pohybováním a přetáčením zkumavky.
• V případě, že koncentrace DNA je dostatečná, v roztoku se zformuje klubíčko vláken DNA. Klubíčko vytáhneme háčkem vyrobeným ohnutím špičky sterilní pasterky či špičkou, přeneseme jej do zkumavky se 70% etanolem. Roztok centrifugujeme 10 min při 13 000 rpm. Pokud je koncentrace DNA v roztoku nízká a vlákna DNA tím nejsou okem patrná a nemůžeme je tedy popsaným způsobem vytáhnout, je třeba roztok DNA centrifugovat (13 000 rpm, 20 min, 4 °C). Centrifugací se vytvoří pelet DNA na dně zkumavky.
• Odstraníme horní vrstvu etanolu a přidáme stejný objem 75% etanolu, centrifugujeme (13 000 rpm, 10 min, 4 °C).
• Důkladně odstraníme etanol, krátce (5 min) necháme vyschnout (kapky etanolu usazené po stěnách můžeme případně krátce centrifugovat a odsát pipetou).
![]() DNA nesmí úplně vyschnout, jinak se špatně rozpustí! A naopak, do výsledného roztoku se nesmí dostat zbytky etanolu, které by mohly bránit následným enzymatickým reakcím.
DNA nesmí úplně vyschnout, jinak se špatně rozpustí! A naopak, do výsledného roztoku se nesmí dostat zbytky etanolu, které by mohly bránit následným enzymatickým reakcím.
• Přidáme takové množství TE pufru (pH 8,0) nebo autoklávované dH2O, aby přibližná koncentrace DNA byla 500 ng – 1 µg DNA/µl (nutno zjistit empiricky). DNA resuspendujeme jemným pohybováním zkumavky v horizontálním směru a umístíme na noc do 4 °C.
![]() Intenzitu precipitace můžeme zvýšit tím, že 100% etanol, který použijeme pro precipitaci, je předem předchlazen na -20 °C nebo také tím, že roztok DNA s přidaným etanolem a octanem sodným uložíme do -20 °C na více než 1 hodinu.
Intenzitu precipitace můžeme zvýšit tím, že 100% etanol, který použijeme pro precipitaci, je předem předchlazen na -20 °C nebo také tím, že roztok DNA s přidaným etanolem a octanem sodným uložíme do -20 °C na více než 1 hodinu.
Další informace o precipitaci DNA naleznete zde: Precipitace nukleových kyselin – LabGuide.cz (posunemevasvys.cz)
——————————————————————————————————————————-——————————————————————————————————————————-
4. KONTROLA CELISTVOSTI A KONCENTRACE DNA
Celistvost DNA zkontrolujeme elektroforetickou separací na agarosovém gelu. DNA by měla být patrná jako celistvý, vysokomolekulární proužek. Pokud je místo jednolitého proužku patrná “šmouha”, značí to, že DNA byla degradovaná. Rovněž, pokud nebylo prováděno působení s RNázou, bude také patrná nízkomolekulární “šmouha” ukazující přítomnost degradované RNA.
Koncentrace DNA se stanoví pomocí spektrofotometru či pomocí nanodropu.
