Restrikční štěpení je štěpení DNA pomocí restrikčních enzymů. Restrikční enzymy (restriktázy, restrikční endonukleázy) jsou klasifikovány jako endonukleázy. Jejich biochemickou aktivitou je hydrolýza (štěpení) fosfodiesterové vazby.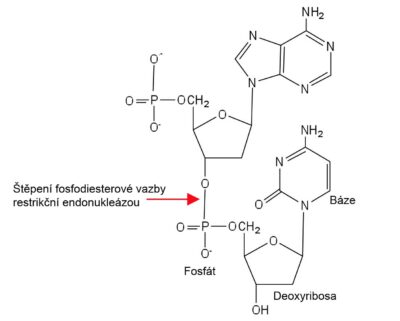
Restrikční endonukleázy pocházejí nejčastěji z baktérií, kde slouží k obrannému mechanismu proti bakteriálním virům nebo nežádoucím plasmidům. Cizorodá DNA je pomocí bakteriální restriktázy v daných sekvencích štěpena, zatímco DNA hostitelského organismu je před tímto štěpením chráněna aktivitou enzymu metyltransferázy, která dané sekvence v hostitelském genomu metyluje a tím v těchto sekvencích štěpení blokuje. Jedná se o tzv. restrikčně/modifikační systém.
Štěpení restriktázami probíhá na fosfodiesterové vazbě na obou řetězcích dvouřetězcové DNA.
————————————————————————————————————————————————————————————————————————————————————————————
ROZPOZNÁVANÁ SEKVENCE
Rozpoznávaná sekvence restrikčních enzymů je nejčastěji palindromickou sekvencí, tzn. takovou sekvencí, která je stejná, když se čte stejně zepředu jako zezadu. Přičemž rozlišujeme zrcadlový palindrom, kdy se sekvence čte tímto způsobem v rámci jednoho řetězce (např. CTAATC) nebo invertovaný palindrom, kdy se takto čte sekvence v rámci obou komplementárních řetězců (např. GAATTC, komplementární sekvence je CTTAAG).
————————————————————————————————————————————————————————————————————————————————————————————
TYPY RESTRIKTÁZ
V současné době je známo asi 3000 restriktáz, z toho asi 600 je komerčně dostupných. Podle aktivity rozlišujeme restriktázy na tři typy, I, II a III.
Restriktázy typu I. Rozpoznávací místo je tvořeno ze dvou sekvencí, jedna z těchto sekvencí je dlouhá 3 – 4 nukleotidů a druhá je dlouhá 4 – 5 nukleotidů, přičemž mezi oběma sekvencemi je vzdálenost 6 – 8 nukleotidů. Tyto enzymy fungují jako tři různé jednotky. Jedna jednotka je zodpovědná za rozlišení rozpoznávací sekvence a vazbu na DNA, druhá má metyltrasferázovou aktivitu, tj. zajišťuje metylaci hostitelské DNA, a třetí jednotka zajišťuje štěpení DNA. Ke štěpení DNA dochází v místě, které je nejméně 1000 bází vzdálené od rozpoznávací sekvence. Pro svou aktivitu tyto restriktázy vyžaduji S-adenosyl metionin, ATP a Mg2+ ionty.
Restriktázy typu II. Klasická restriktáza typu II je tvořena jednou jednotkou (je tedy homodimerem), rozpoznává palindromickou sekvenci dlouhou 4 – 8 bází a tuto sekvenci i štěpí. Jedná se o nejčastěji využívaný typ restriktáz v genovém inženýrství.
Ovšem existují i novější a méně klasické typy restriktáz typu II, které se rozdělují na následující skupiny:
Restriktázy IIB jsou multimery, obsahují tedy více jednotek a štěpí DNA na obou koncích rozpoznávacího místa.
Restriktázy typu IIS štěpí DNA v určité vzdálenosti od rozpoznávacího místa, které je asymetrické a není palindromem.

Restriktázy typu IIM rozpoznávají a štěpí metylovanou DNA. Příkladem je DpnI.
Restriktázy typu III rozpoznávají dvě nepalindromické sekvence, které jsou v inverzní orientaci. Štěpení probíhá 20 – 30 bází za rozpoznávacím místem.

———————————————————————————————————————————————————————————————————————————————————————————
NÁZVOSLOVÍ
Vzhledem k velkému počtu nejrůznějších restriktáz, bylo vyvinuto přesné názvosloví. Každá restriktáza je pojmenovaná podle druhu a kmene bakterie, z níž byla izolovaná. Např. restriktáza EcoRI má svůj název odvozen od E (Escherichia), co(coli), R (kmen RY13) I (pořadí identifikace). Enzymy o stejné specificitě jsou často vzhledem k patentovému právu komerčně izolovány z různých bakteriálních druhů nebo kmenů. Díky zavedenému názvosloví se pak tyto enzymy, ač rozpoznávají stejnou sekvenci, jmenují jinak. Hovoříme o tzv. isoschizomerách.
————————————————————————————————————————————————————————————————————————————————————————————
VYUŽITÍ RESTRIKTÁZ
Restriktázy jsou využívány k metodám jako je:
• AFLP (Amplified Fragment Length Polymorphism)
• RFLP (Restriction Fragment Length Polymorphism)
• STRP (Short Tandem Repeat Polymorphism)
• fragmentaci DNA
• při molekulární klonování fragmentu DNA do vektoru či spojování dvou fragmentů DNA dohromady.
Využití restriktáz při klonování. Při štěpení restriktázami typu II můžeme získat fragmenty se dvěma typy konců – s konci tupými a konci kohezivními („přečnívajícími“). Kohezivní konce vznikají činností restriktáz, které štěpí obráceně opakované sekvence. Tupé konce vznikají štěpením fosfodiesterové vazby na stejném místě v obou řetězcích, takže vnikají tupé konce.
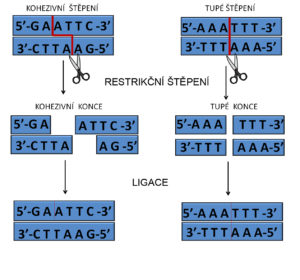
Štěpení restrikčními endonukleázami dovoluje, při určitých podmínkách a přítomnosti enzymu, tzv. DNA ligázy, rozštěpené molekuly zase spojit dohromady. Snížením teploty dosáhneme mezi štěpenými konci spojení vodíkovými můstky a pomocí enzymu můžeme fosfodiesterové vazby mezi řetězci obnovit
————————————————————————————————————————————————————————————————————————————————————————————
AKTIVITA A POTŘEBNÉ MNOŽSTVÍ ENZYMŮ
Enzymy jsou dodávány v určitém množství jednotek. Jednotka je definovaná jako takové množství enzymu, které je potřebné k úplnému rozštěpení 1 μg DNA z bakteriofága λ za 1 hodinu při dané teplotě v 50 μl reakci.
Prakticky se ale restrikční štěpení obvykle dělá tak, že se k 1 µg DNA přidá 0,5 µl restriktázy, což je obvykle množství enzymu, které DNA dokonale naštěpí.
————————————————————————————————————————————————————————————————————————————————————————————
INAKTIVACE RESTRIKČNÍHO ŠTĚPENÍ METYLACÍ ROZPOZNÁVACÍHO MÍSTA
Aktivita některých restrikčních enzymů může být blokovaná metylací rozpoznávané sekvence. Jedná se buď o prokaryotickou metylaci (tzv. dam a dcm metylace) nebo eukaryotickou metylaci (tzv. CpG metylaci). Citlivost na metylaci je před daným experimentem potřebné zkontrolovat.
Prokaryotická metylace
U prokaryot enzymy označované jako metyltransferázy metylují sekvence DNA jako součást restrikčně modifikačního systému. Většina používaných laboratorních kmenů E. coli obsahuje tři typy metylací DNA:
Dam metylace – metylace adeninu v pozici N6 v sekvenci GATC
Dcm metylace – metylace druhého cytosinu v pozici C5 v sekvenci CCAGG a CCTGG
EcoKI metylace – metylace adeninu v sekvencích AAC(N6)GTGC a GCAC(N6)GTT.
Rozsah metylace se může značně lišit, nicméně i tak může metylace vyústit až v úplné zablokování štěpení dané sekvence příslušnou restriktázou.
Pro zamezení prokaryotické metylace můžeme využít dam–/dcm– kompetentní buňky, v nichž je tato metylační aktivita blokována.
Eukaryotická metylace
Jedná se o výsledek aktivity tzv. CpG metyltransferáz, které se nacházejí u vyšších eukaryot a metylují cytosin na C5. CpG metylace hrozí v případě, že štěpená genomová DNA byla předtím izolovaná přímo z eukaryotického organismu. Naopak, tato metylace nehrozí, pokud množíme zaklonovaný úsek, byť původně z eukayrotního organismu, v baktériích. Nicméně zde zase může hrozit prokaryotická metylace.
————————————————————————————————————————————————————————————————————————————————————————————
STAR AKTIVITA
Za podmínek, které nejsou pro reakci optimální, mohou některé restriktázy štěpit nespecificky, tj. štěpí i v jiných sekvencích, než jsou jejich rozpoznávací. Obvykle se to děje, pokud štěpená DNA není dostatečně čistá, je použito příliš velké množství enzymu nebo je reakce prováděna za přítomnosti velkého množství solí či reakce běží příliš dlouho.
————————————————————————————————————————————————————————————————————————————————————————————
PUFRY
Restriktázy obvykle pracují při poměrně jednoduchých reakčních složeních. Reakce pro restrikční štěpení obvykle obsahuje 6-10 mM Tris-HCl (pH 7,5), 10 mM MgCl2 a 0-150 mM soli (obvykle NaCl). Podle koncentrace soli nebo typu soli dělíme komerční pufry na:
• pufry s nízkou koncentrací solí (0-10 mM NaCl),
• pufry se střední koncentrací solí (50-75 mM NaCl),
• pufry s vysokou koncentrací solí (100-150 mM NaCl),
• pufry s KCl místo NaCl,
• universální pufry (acetátové), které obsahují Mg-acetát a Tris-acetát místo MgCl2 a Tris-HCl. V acetátových pufrech jsou enzymy schopny štěpit ve větším rozsahu koncentrace soli.
Pro zvýšení stability enzymů je u delších reakčních časů doporučován také přídavek 0,1 mg/ml BSA (hověsí sérový albumin) nebo 1 mM merkaptoetanol, 1 mM ditioerytritol (DTE) či 1 mM ditiotreitol (DTT) proti jejich oxidaci.
Komerčně je dostupná celá řada restrikčních enzymů, stejně tak je dodáván set pufrů, ve kterých příslušné restriktázy pracují. Aktivita různých restriktáz se v různých pufrech může výrazně lišit nebo naopak jsou restiktázy, které pracují v jakémkoliv z dodaných pufrů se 100% aktivitou.
Pokud chceme provádět reakci s např. dvěma enzymy současně, vždy musíme zkontrolovat jejich aktivitu v daných pufrech a použít optimální pufr pro oba enzymy. Pokud se aktivita výrazně liší, buď použijeme univerzální pufr, nebo provedeme reakci nejprve s jedním enzymem, DNA přečistíme (buď komerčně dostupnou kolonkou, nebo precipitací) a provedeme reakci s druhým enzymem.
Dodávané pufry jsou většinou 10x koncentrované, tj. do reakce dáme pufr o takovém objemu, aby byl 1/10 celkového objemu reakce (tj. pokud připravujeme 25 µl reakci, použijeme 2,5 µl pufru).
————————————————————————————————————————————————————————————————————————————————————————————
PARCIÁLNÍ ŠTĚPENÍ
Parciálním štěpením se rozumí částečné štěpení, tzn., takové štěpení, při kterém jsou v reakci rozštěpena jen některá rozpoznávaná místa, z těch, které se na molekule nachází. V praxi lze parciálního štěpení cíleně využít, a to tak, že pro reakci použijeme malou koncentraci enzymu, s tím, že v průběhu reakce postupně odebíráme časové vzorky (např. po 1 min, 5 min, atd.)
————————————————————————————————————————————————————————————————————————————————————————————
INAKTIVACE ENZYMU PO REAKCI
Inaktivace se provádí zahřátím na určitou teplotu po určitou dobu, a to dle typu enzymu (viz. tabulka) nebo se případně může použít EDTA, která vyváže dvojmocné ionty, či tak extrahovat fenolem.
————————————————————————————————————————————————————————————————————————————————————————————
REAKČNÍ PODMÍNKY A PROVEDENÍ REAKCE
Reakční podmínky, případně podmínky inaktivace je vždy třeba zkontrolovat pro daný enzym, a to dle návodu dodaného výrobcem. Standardně se reakce provádí v 25 μl objemu, kdy se štěpí 1 μg DNA s 0,5 μl enzymu (viz. uvedený příklad) nebo násobcích tohoto reakčního složení. Štěpení provádíme 1 – 2 hodiny, lze štěpit i přes noc, ale s prodlužující se inkubací lze také očekávat zvyšující se riziko star aktivity.
U většiny enzymů je optimální teplota reakce 37oC, jsou ovšem i enzymy (jedná se o enzymy izolované z termofilních baktérií), které vyžadují teplotu nad 50oC nebo naopak enzymy, které štěpí při pokojové teplotě.
Pokud děláme reakci s více enzymy, vždy mějme na paměti, že objem dodaných enzymů nesmí přesáhnout 1/10 celkového objemu reakce, tzn. množství glycerolu nesmí nepřesáhne 5% v/v (glycerol, který je přítomný v dodaném roztoku s enzymem, by ve větším množství reakci blokoval).
Po provedení reakce můžeme enzym inaktivovat. Úspěšnost štěpení ověříme elektroforeticky.
Příklad provedení reakce:

Reakci promícháme a inkubujeme při 37 °C 1 – 2 hodiny. Reakci můžeme inaktivovat inkubací při 65 °C 20 min. Výsledek reakce zkontrolujeme elektroforetickou separací.
————————————————————————————————————————————————————————————————————————————————————————————
PROBLÉMY PŘI RESTRIKČNÍM ŠTĚPENÍ
Nejčastějším problémem při restrikčním štěpení je neštěpení rozpoznávané sekvence, případně parciální štěpení. V těchto případech je třeba ověřit:
• vhodnost reakčních podmínek,
• možnost inaktivace enzymu metylací,
• kvalitu enzymu,
• kvalitu preparátu DNA (pokud DNA není dostatečně čistá a tedy obsahuje látky inhibující štěpení, je třeba vzorek přečistit, optimálně však připravit nový),
• přítomnost rozpoznávané sekvence ve vzorku.
Pokud je vzorek štěpen nespecificky, tj. enzym štěpí i v jiných sekvencích, než jsou jejich rozpoznávací, jedná se o star aktivitu.
————————————————————————————————————————————————————————————————————————————————————————————
Tabulku s běžně dostupnými restriktázami, jejich rozpoznávacími sekvencemi a reakčními podmínkami najdete zde.
————————————————————————————————————————————————————————————————————————————————————————————
Literatura:
www. New England Biolabs. com
Green & Sambrook (2012) Molecular Cloning. Cold Spring Harbor Laboratory Press.
