Imunologické metody jsou založeny na interakci protilátky s antigenem, přičemž jeden z páru je vždy známý a druhý je vyšetřovaný, ten stanovujeme kvalitativně či kvantitativně podle povahy zvolené metody. Tzn. stanovujeme-li antigen, dodáváme do reakce známé specifické protilátky, v opačném případě prokazujeme hledanou protilátku pomocí známého antigenu. Vzniklý komplex protilátka-antigen lze detekovat různými způsoby, díky čemuž zahrnuje skupina imunologických metod širokou škálu laboratorních analýz jako jsou precipitační, aglutinační a imunodifúzní metody, dále neutralizační testy či komplement-fixační reakce a nebo metody využívající značených výchozích látek reakce jako je ELISA (enzyme linked immunosorbent assay) či imunofluorescenční metody. V klinickém prostředí bývají rovněž souhrnně označované jako „sérologické metody“, jelikož se často jako vstupní materiál využívá vzorek krevního séra. Největší využití nacházejí tyto metody ve virologii a bakteriologii.
———————————————————————————————————————————————————————————————————————————————————————————-
Precipitační metody
Při precipitačních metodách se využívá detekce imunoprecipitátu, který vzniká vytvářením nerozpustných polymerů sestávající z komplexů protilátka-antigen. Imunoprecipitát vzniká v tzv. zóně ekvivalence, tedy za podmínek, kdy je poměr koncentrace antigenu a koncentrace protilátky v reakci optimální. Za přebytku protilátky precipitát nevzniká z důvodu volných vazebných míst na molekule protilátky, nedochází tak k jejich provázání přes antigen. Stejně tak nevzniká precipitát při přebytku antigenu, protože není zajištěno provázání jednotlivých komplexů do polymeru vlivem chybějících protilátek. Ne všechny protilátky mají ovšem schopnost precipitace. Nevhodné protilátky pro precipitace jsou zejména monovalentní protilátky, tedy protilátky mající jen jedno vazebné místo, z toho důvodu jsou neschopné precipitovat antigeny. Precipitační metody mohou být prováděny volně v roztoku, výsledek je pak stanoven s využitím některých optických metod (odkaz), např. turbidimetricky. Metody lze provádět i na gelu, přičemž tento způsob je založen na difúzi a tvoří tak speciální podskupinu zvanou imunodifúzní metody.

Imunodifúzní metody
Mezi hojně využívané imunodifúzní metody patří jednoduchá imunodifúze, dvojitá imunodifúze a nebo imunoelektroforéza:
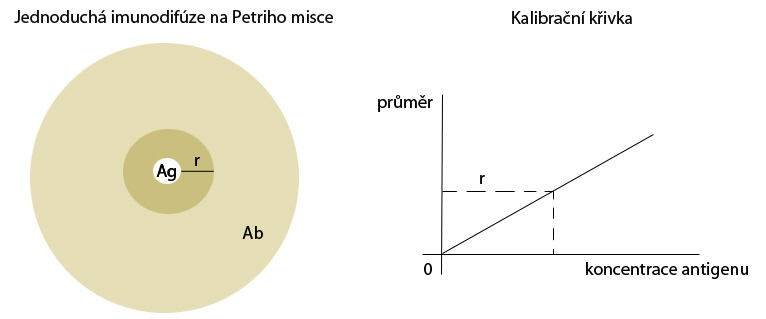
–Jednoduchá imunodifúze spočívá v difúzi antigenu (Ag) z jamky do okolního gelu, v němž je rozptýlena protilátka (Ab). Průměr nebo poloměr (r) vytvořeného precipitačního prstence kolem jamky pak slouží k výpočtu koncentrace antigenu v testovaném vzorku, tato hodnota se odečítá z kalibrační křivky sestrojené s pomocí známých a předem stanovených koncentrací antigenu (viz obrázek). Metoda je tak vhodná ke kvantitativnímu stanovení antigenu.
–Dvojitá imunodifúze má trochu odlišný princip. Gel na dvojitou imunodifúzi je čistý, bez inkorporované protilátky. V něm se vytvoří jamky, přičemž do jedné se nanese antigen, do druhé protilátka, obě látky pak difundují proti sobě. V zóně ekvivalence se vytváří precipitační linie. Uspořádání jamek může být libovolné, např. pouze dvě jamky naproti sobě a nebo více jamek, kdy uprostřed může být jamka se sérem obsahující protilátky a okolo ní potom několik jamek s různými antigeny (viz obrázek). Dvojitá imunodifúze je vhodná zejména pro kvalitativní průkaz antigenu a nebo pro určení příbuznosti testovaných antigenů.
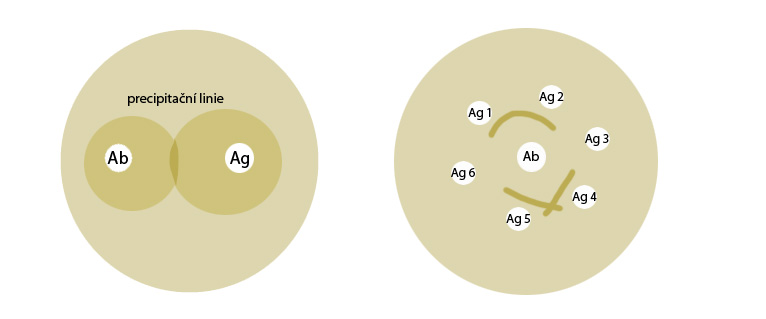
Obrázek: Vlevo Petriho miska s jednodušším uspořádáním dvou jamek naproti sobě, v jedné je protilátka (Ab), v druhé je antigen (Ag), mezi nimi v zóně ekvivalence se vytváří precipitační linie. Vpravo Petriho miska se složitějším uspořádáním, jamka uprostřed obsahuje protilátky, jamky okolo ní obsahují různé antigeny (Ag 1-6). Z tvarů precipitačních linií lze vyčíst, že antigeny 1 a 2 jsou identické díky charakteristicky zaoblené linii, naopak antigeny 4 a 5 jsou vzhledem k vytvořeným překříženým liniím neidentické. S antigeny 3 s 6 protilátky netvořily komplexy.
–Imunoelektroforéza. Při imunoelektroforéze dochází nejprve k rozdělení směsi protilátek, resp. antigenů, na gelu ve stejnosměrném elektrickém poli jako při klasické elektroforéze. Ve druhém kroku se podél zóny rozdělení vyřízne žlábek, do něhož se nanese antisérum, dochází k difúzi látek proti sobě a vytvoření několika precipitačních linií. Využívá se opět hlavně ke kvalitativním stanovení, např. při detekci poruch syntézy některých tříd imunoglobulinů.
———————————————————————————————————————————————————————————————————————————————————————————-
Aglutinační metody
Na rozdíl od precipitačních metod, kdy jsou antigeny v roztoku volně rozpustné, je v případě aglutinace antigen korpuskulárního charakteru, tedy navázán na nerozpustné partikule. Často se jedná o latexové partikule, červené krvinky a nebo celé bakteriální buňky. Vznikající komplexy protilátky s antigenem jsou pak označované jako aglutinát, nikoliv precipitát. Nicméně podstata obou metod je shodná, tedy tvorba imunokomplexu pouze za vhodného poměru koncentrací vzájemně reagující protilátky a antigenu.
———————————————————————————————————————————————————————————————————————————————————————————-
Neutralizační reakce
Neutralizační reakce spočívají v zablokování vlastností antigenu protilátkami, jsou-li ve vyšetřovaném vzorku přítomny. Pokud se protilátky ve vzorku vyskytují, dochází např. k zablokování schopnosti bakteriálního toxinu lyzovat červené krvinky, nebo k zabránění cytopatického efektu viru na buněčné kultuře a nebo i schopnosti viru infikovat pokusné zvíře. Je důležité zmínit, že ne všechny protilátky interagující s daným antigenem (toxinem, virem) jsou neutralizační, tzn. zabraňující interakci antigenu s cílovou buňkou. Takže zatímco např. precipitačními a aglutinačními metodami detekujeme všechny tyto interagující protilátky, metodou neutralizační reakce detekujeme čistě protilátky neutralizační. Test se většinou provádí v několika ředěních daného séra a výsledkem je koncentrace séra (titr protilátek), u něhož ještě dochází k neutralizaci antigenu. Důležité je také zahrnout pozitivní a negativní kontrolu.
———————————————————————————————————————————————————————————————————————————————————————————-
Komplement-fixační reakce
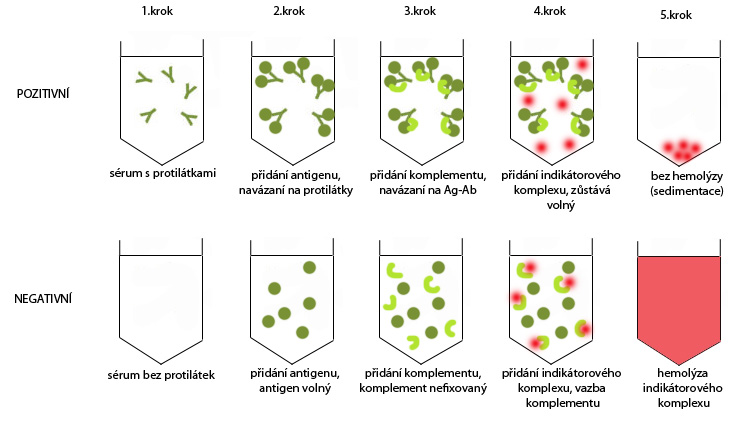
Komplement-fixační reakce slouží k průkazu protilátek a využívá se v nich vlastnosti komplementu lyzovat buňky. Vstupním vzorkem je sérum, které testujeme na přítomnost protilátek. U tohoto vzorku je nejprve tepelně inaktivován komplement vyšetřovaného (1.krok), poté se ke vzorku přidá testovaný antigen (2.krok). Pokud jsou proti tomuto antigenu přítomny protilátky, vytváří se komplexy protilátka-antigen (Ag-Ab), pokud protilátky přítomny nejsou, antigen je volný. V dalším kroku je do vzorku přidán komplement (experimentálně získaný z pokusného zvířete), který se váže na komplexy protilátka-antigen za předpokladu, že se ve vzorku vyskytují a pokud nikoliv, zůstává komplement nefixovaný (3.krok). V posledním kroku je do reakce přidán indikátorový komplex, jedná se o červené krvinky s navázanou protilátkou, tzv. senzibilizované erytrocyty (4.krok). Pokud v předešlém kroku došlo k vyvázání komplementu na již přítomný komplex protilátka-antigen, nedochází k hemolýze indikátorového komplexu, dochází pouze k jeho sedimentaci (5.krok, nahoře). Ovšem v případě, že protilátky ve vyšetřovaném vzorku nebyly přítomny, komplement tedy zůstal nefixovaný a v posledním kroku se váže na indikátorový komplex a způsobuje jeho hemolýzu (5.krok, dole).
———————————————————————————————————————————————————————————————————————————————————————————-
ELISA
ELISA je imunologická metoda, v níž se k detekci antigenu (Ag) využívá protilátka (Ab) konjugovaná s enzymem (E). Metoda se provádí na mikrotitračních destičkách, k jejichž dnu mohou vznikající imunokomplexy pevně přilnout a poté být detekovány. Při samotné detekci probíhá specifická reakce katalyzovaná daným enzymem, v níž je výchozí bezbarvý substrát přeměněn na barevný produkt, přičemž intenzita zbarvení je přímo úměrná koncentraci stanovovaného analytu. Jde o tzv. kolorimetrickou kvantifikaci.
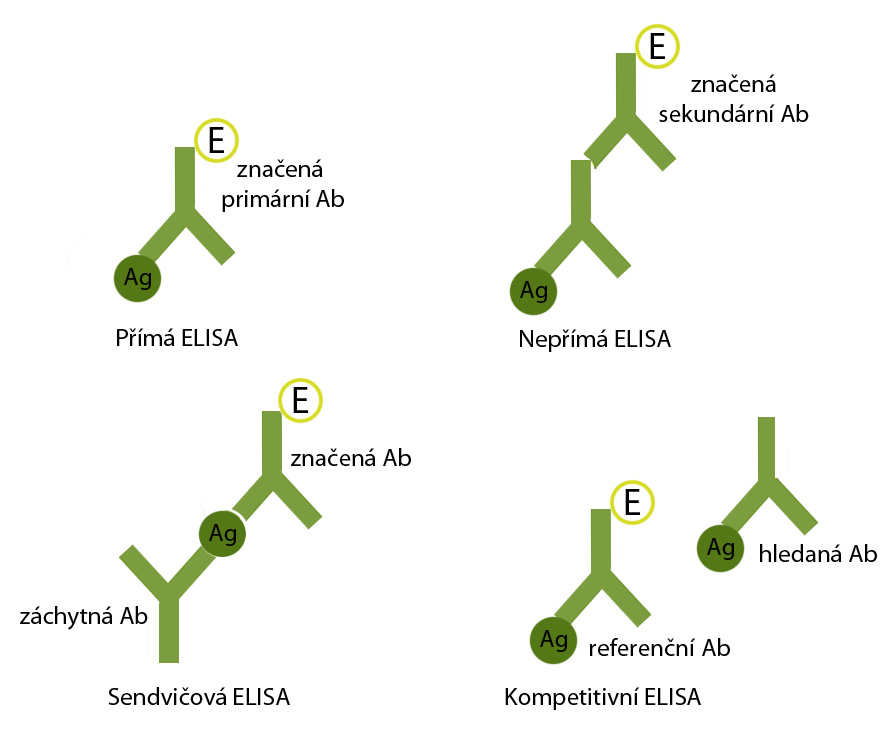
Podle uspořádání jednotlivých komponentů reakce rozlišujeme několik typů metody – ELISA přímá, nepřímá, sendvičová a kompetitivní (viz obrázek):
–Přímá ELISA má nejjednodušší uspořádání. Na hledaný antigen se přímo váže značená protilátka, tzv. primární protilátka, která je poté rovnou detekována.
–Nepřímá ELISA má oproti té přímé krok navíc. Nejprve se váže na antigen primární protilátka, v dalším kroku je přidána značená protilátka proti primární protilátce, tzv. sekundární protilátka, a ta je v závěru detekována. Tímto uspořádáním je umožněna amplifikace detekovaného signálu a je také zajištěna větší specificita reakce.
–Sendvičová ELISA se vyznačuje speciálním uspořádáním, kdy jsou na dně jamky navázané a imobilizované protilátky proti hledanému antigenu (tzv. záchytné protilátky), do jamky je nanesen testovaný vzorek s hledaným antigenem, nenavázaný antigen je následovně odmytý a v dalším kroku je přidána značená protilátka proti danému antigenu, která je nakonec detekována.
–Kompetitivní ELISA spočívá v kompetici hledaného antigenu s referenčním značeným antigenem o vazebné místo na dodané protilátce, resp. referenční značená protilátka soutěží s hledanou neznačenou protilátkou o antigen. Jinými slovy koncentrační převaha jednoho z kompetujících vede k vytěsnění druhého z kompetujících. Uspořádání tohoto typu lze měnit dle potřeby.
Obvyklý postup:
- Adsorpce antigenu/ záchytné protilátky na dno jamky. Děje se na základě nekovalentních interakcí, proto je potřeba vytvořit ideální prostředí (koncentrace iontů, pH, teplota). Většinou se využívá 0.1 M bikarbonátový pufr o pH 9.6, bývá nazýván coating buffer a nechává se působit se vstupním vzorkem většinou přes noc při chladničkové teplotě.
- Promytí, tj. odstranění reagentů, které neadsorbovaly na dno jamky. K promývání se nejčastěji využívá roztok PBS nebo PBST (PBS s detergentem Tween 20), např. 10 mM PBS o pH 7.5.
- Blokace slouží k obsazení nespecifických vazebných míst na antigenu/ záchytné protilátce, tento krok tak zvyšuje specificitu reakce. K blokaci se využívá např. 2% BSA (bovine serum albumin) nebo 5% odtučněné mléko.
- Promytí.
- Tvorba imunokomplexu. Přidání značené protilátky/ antigenu dle uspořádání jednotlivých komponentů reakce.
- Promytí.
- Přidání substrátu. Substrát se liší dle typu enzymu, který je použit ke značení daného imunoreagentu. Pokud je využito enzymu zvaného křenová peroxidáza, přidává se substrát tetramethylbenzidin. Ten se činností enzymu mění v modře zbarvený produkt. V případě využití enzymu alkalická fosfatáza se jako substrát přidává p-nitrofenylfosfát, který se činností enzymu přeměňuje na žlutý produkt. Měly by být vždy zajištěny optimální podmínky pro správný průběh reakce, nejčastěji se reakce odehrává v temnu při 37 °C po dobu 60 minut.
- Zastavení katalytické reakce. Katalytická reakce substrátu s enzymem se cca po 40-60 minutách musí zastavit, děje se tak nejčastěji okyselením, např. přidáním 0.5 M H₂SO₄. Až poté (asi 10 minut po zastavení) přichází na řadu samotné vyhodnocení.
- Kvantifikace, tj. měření optické denzity při dané vlnové délce (absorpční maximum pro produkt enzymatické reakce). Paralelně s testovaným vzorkem se stanovuje také ředicí řada, která slouží k sestrojení kalibrační křivky. Z té se pak na základě naměřené absorbance analytu odečítá jeho koncentrace.
![]() Jamky destičky se mezi jednotlivými kroky musejí nechat vždy ponořené v některém z roztoků (nejlépe v promývacím roztoku) a nikdy by se neměly nechat vyschnout!
Jamky destičky se mezi jednotlivými kroky musejí nechat vždy ponořené v některém z roztoků (nejlépe v promývacím roztoku) a nikdy by se neměly nechat vyschnout!
———————————————————————————————————————————————————————————————————————————————————————————-
Imunofluorescence
Imunofluorescenční metody se využívají k vizualizaci a lokalizaci hledaného antigenu pomocí fluorescenčně značené protilátky přímo ve tkáních nebo třeba na v buněčných kulturách, tzn. protilátka je konjugovaná s fluorochromem. Metoda je většinou prováděna na mikrotitračních destičkách a nebo na sklíčku. Výsledek je prohlížen pod fluorescenčním nebo konfokálním mikroskopem a je zaznamenáván citlivou CCD kamerou.
Obvyklý postup:
- Fixace pro dokonalé zachování buněčných struktur a permeabilizaci membrán. Fixační roztok je po době svého působení odstraněn a po něm následuje ihned blokace.
- Blokace k obsazení nespecifických vazebných míst na antigenu.
- Promytí za užití roztoku PBST (PBS s detergentem Tween 20).
- Tvorba imunokomplexu. Většinou se provádí nepřímé uspořádání, tj. nanesení primární neznačené protilátky, promytí a pak nanesení sekundární značené protilátky. Ke značení se nejčastěji využívá fluoresceinizothiokyanát (FITC) nebo tetrametylrhodaminizothiokyanát (TRITC).
- Promytí.
- Značení jader pomocí DAPI. DAPI se váže na dvojvláknovou DNA a jeho excitováno ultrafialovým světlem (excitační maximum při 358 nm), pod mikroskopem září modře (emisní maximum při 461 nm), využívá se tak k detekci jader a pro snažší orientaci v rámci buňky. Je důležité, aby použitá fluorescenční značka měla jiné excitační a emisní maximum právě než DAPI.
- Promytí.
- Prohlížení. Pokud je metoda prováděna na mikrotitrační destičce, nanese se na závěr do každé jamky PBS a pak lze prohlížet pod mikroskopem. Pokud je metoda prováděna na sklíčku, nanese se na něj v posledním kroku DABCO a nebo MOWIOL, což jsou vodná montovací média pro trvalé preparáty, preparát se přiklopí krycím sklíčkem a posléze lze mikroskopovat.
