Mikroskopické techniky využíváme v laboratoři k zobrazení drobných struktur, které nelze běžně pozorovat okem. Zatímco rozlišovací schopnost lidského oka je 0.2 mm (rozliší dva body vzdálené od sebe 0.2 mm, při menší vzdálenosti se body vizuálně slévají do jednoho), rozlišovací schopnost mikroskopů je až 0.1 nm, tzn. o 6 řádů větší. Díky tomu lze pozorovat nejen drobné živočichy, ale i jednotlivé tkáně a buňky, organely, či makromolekuly až na úroveň atomů.
Mikroskopické techniky můžeme rozlišit na dvě hlavní skupiny podle typu využívaného záření. První z nich je světelná mikroskopie, při které je k zobrazení pozorovaných předmětů využíváno světelného záření (toku fotonů). Druhou z nich je pak elektronová mikroskopie, při které je k zobrazení využito proudu elektronů. Nahrazením světla elektrony lze totiž dosáhnout mnohem většího rozlišení díky jejich nižší vlnové délce. Tyto dvě skupiny se pak dále dělí na mnoho podskupin podle uspořádání mikroskopů, přičemž každé uspořádání sebou nese určité výhody i nevýhody, podle toho se liší i jejich využití.
———————————————————————————————————————————————————————————————————————————————————————————-
Světelná mikroskopie
Do této podskupiny patří nejen klasická mikroskopie ve světelném poli, ale i mikroskopie temného pole, polarizační mikroskopie, mikroskopie s fázovým kontrastem, fluorescenční, konfokální, ultrafialová a nebo infračervená mikroskopie. Rozlišovací schopnost světelných mikroskopů sahá až k hodnotě 0.25 µm, přičemž tato hodnota je dána vlnovou délkou fotonů a také vlastnostmi objektivů. Největší zvětšení, které lze dosáhnout světelným mikroskopem je 1000x. Světelnou mikroskopii využíváme při přípravě a zpracování preparátů, dále pro zaznamenání pozorovaných výsledků, zejména pak v histologii. Příprava preparátů je většinou jednoduchá, relativně levná (stejně tak jako potřebné vybavení) a trvá maximálně několik hodin, lze pozorovat i živé objekty. Vzhledem k jejímu širokému uplatnění je nejpoužívanější ať už ve výzkumu nebo v klinické praxi.
Světelný mikroskop je vždy složen z optické (objektiv a okulár), osvětlovací (světlo a kondenzor) a mechanické části (stativ, tubus s revolverovým kotoučem objektivů, držák osvětlovací soustavy, stolek mikroskopu):
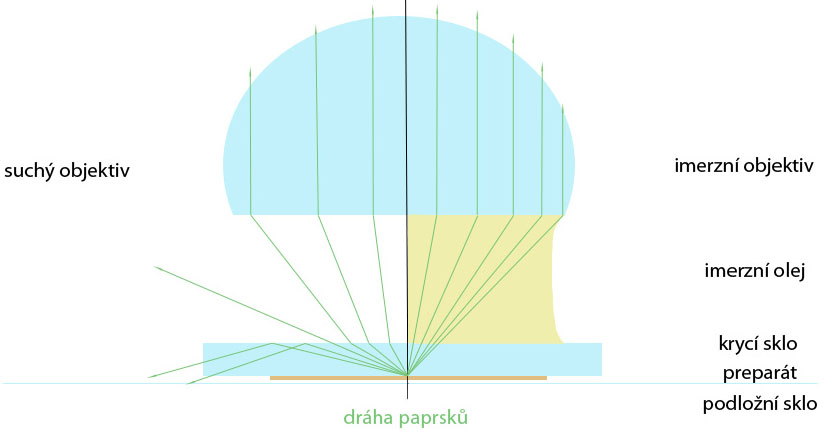
•Objektiv: spojná čočka, která vytváří zvětšený, převrácený a skutečný obraz předmětu. Hodnota zvětšení objektivů se pohybuje v rozmezí 4x-100x. Mimo zvětšení je důležitým údajem také numerická apertura, ta popisuje schopnost objektivu zachytit určitý úhel paprsků vycházejících s preparátu a popisuje tak hloubku ostrosti obrazu, který je objektiv schopen vytvořit. Platí tak, že čím větší je numerická apertura objektivu, tím kvalitnější je objektiv, protože zachytí více paprsků a vytvoří ostřejší obraz. Objektivy rozlišujeme suché a imerzní. U suchých objektivů je mezi preparátem a objektivem vzduch. Jejich numerická apertura je zpravidla menší než 1, jelikož dochází při přechodu paprsků z jednoho prostředí do druhého (tj. krycí sklo preparátu – vzduch – čočka objektivu) k jejich ztrátě. Imerzní objektivy lze odlišit od suchých podle jednoho nebo dvou černých proužků na svém plášti a označení „oL.im“ nebo „oil“. Vyžadují použití vodní nebo olejová imerze, ta se kápne na krycí sklo preparátu a objektiv se do ní ponoří. Tím je dosaženo menším ztrátám světelných paprsků při přechodu mezi prostředími a obraz tak obsahuje více detailů (sklo a imerzní olej mají téměř shodnou lomivost paprsků), jejich numerická apertura je větší než 1 (viz obrázek).
•Okulár: spojná čočka, která zvětšuje obraz vytvořený objektivem. Jedná se o tzv. prázdné zvětšení, jinými slovy nepřidává víc detailů pozorovaného objektu nežli objektiv, který poskytuje tzv. užitečné zvětšení. Obraz, který pozorujeme skrz okulár je zvětšený, neskutečný a převrácený. Mají pevné zvětšení 10x.
•Zdroj světla: klasická nebo halogenová žárovka, u fluorescenčních mikroskopů silnější zdroj záření, většinou rtuťová nebo xenonová výbojka.
•Kondenzor: soustava čoček/zrcadel sloužící k usměrnění paprsků ze světelného zdroje, tak aby rovnoměrně dopadaly na preparát.
•Stativ: noha mikroskopu a nosič tubusu.
•Tubus: trubice spojující okulár a objektiv.
•Revolverový kotouč: umožňuje měnit objektivy, resp. zvětšení.
Postup při mikroskopování:
- Zkontrolovat, zda je mikroskop i pracovní plocha kolem čistá. Zapnout osvětlení na mikroskopu. Připevnit preparát krycím sklem vzhůru na stolek mikroskopu.
- Nastavit objektiv s nejmenším zvětšením a pomocí makrošroubu k němu přiblížit stolek na co nejmenší vzdálenost – kontrolovat pohledem ze strany, aby nedošlo k nárazu objektivu do stolku, resp. preparátu!
- Pomocí makrošroubu pomalu oddalovat stolek za současného pohledu do okulárů než spatřím objekty preparátu, poté doostřit pomocí mikrošroubu. Pokud disponují okuláry dioptrickou korekcí, doostřit obraz jimi podle individuálních potřeb.
- Zkontrolovat správné osvětlení preparátu, mělo by být rovnoměrné a přiměřeně intenzivní.
- Pracovat vždy od nejmenšího zvětšení k největšímu. Při změně objektivů přizpůsobovat intenzitu osvětlení. Při prohlížení preparátu zvolit jednotné schéma prohlížení – prohlížet sklíčko tzv. bajonetovým a nebo meandrovitým pohybem.
- Při využití imerzních objektivů, zkontrolovat nejprve imerzní médium, zda není nikterak zakalené. Kápnout imerzi na preparát v místě zájmu pozorování, pootočit revolverový nosičem na imerzní objektiv a pohledem ze strany k němu pomalu přibližovat stolek až k jeho ponoření do kapky imerze, obraz doostřit pohledem do okuláru mikrošroubem. Po použití otřít preparát a objektiv např. buničinou navlhčenou benzinem. Dbát na opatrnost, při namočení suchého objektivu do imerze by mohlo dojít k jeho nenávratnému poškození!
- Při pořizování fotografií je potřeba vždy zahrnout zvětšení, při kterém byla fotografie pořízena a dobře viditelné měřítko. Dodatečně lze upravovat expozici, kontrast, jas atd.
- Při výměně preparátů nastavit zpět nejmenší zvětšení a stolek do nejnižší polohy a poté až vkládat nový preparát. Při přerušení práce vypínat osvětlení.
- Po úplném ukončení práce otřít preparáty a imerzní objektivy od imerze, případně očistit okuláry a stolek. Ztlumit osvětlení na nejnižší úroveň a vypnout (při dalším zapnutí by při nastavení intenzity světla na maximum mohlo hrozit prasknutí žárovky). Vrátit stolek do nejnižší polohy. Revolverový nosič nastavit na objektiv s nejmenším zvětšením. Přikrýt mikroskop ochrannou fólií/krytem.
Mikroskopie ve světelném poli
-Jedná se o nejjednodušší a také nejstarší techniku pozorování preparátů. Klasické bílé světlo prochází přímo preparátem a poté do objektivu. Nízký kontrast většiny biologických preparátů se obchází pomocí širokého spektra barvicích technik. Např. nejčastěji je využíváno dvojice barviv hematoxylin-eosin, kdy po obarvení lze odlišit modrofialová jádra (barvená hematoxylinem, který je bazický a tudíž má vysokou afinitu k jádru obsahující nukleovou kyselinu) a růžovou cytoplasmu (barvenou eosinem, je kyselý) buněk zkoumané tkáně, jedná se o tzv. přehledné barvení. Dále existují i speciální barvení, které mají afinitu pouze ke specifickým strukturám ve tkáních, tím je např. olejová červeň (Oil Red O), která barví červeně pouze neutrální lipidy nebo alciánová modř reagující s kyselými polysacharidy za vzniku jasně modré barvy. Pro dobrou prostupnost tkáně takovými barvivy musí být tkáň nejprve fixována, tzn. usmrcena. Ovšem v případě, že chceme zachovat vzorek pro pozorování pod mikroskopem živý, vynecháváme fixaci a barvení a pozorujeme tzv. nativní preparát. Nicméně pro diferenciaci některých buněčných struktur při současném zachování vitality tkáně lze využít i tzv. vitálního barvení (Janusova zeleň, Kongo červeň). Každá laboratoř má svůj specifický postup zpracování preparátu pro světelnou mikroskopii a mohou se významně lišit nejen koncentrace a doba působících reagens, ale i pořadí a počet jednotlivých kroků v protokolu. Údaje v takovém protokolu se odvíjí od zkoumané tkáně, požadavků výrobce barvicího kitu či požadovaného výsledku, a tak zde uvedený postup je pouze orientační. Zde je konkrétně uveden postup pro přípravu řezového preparátu, ale existují také další přístupy v přípravě preparátu, těmi jsou nátěrové, roztlakové nebo mikroreliéfní preparáty…
Obvyklý postup při přípravě preparátu:
- Zpracování tkáně. Provádí se nejčastěji ve fyziologickém (0.9 % vodný roztok NaCl) nebo Ringerovo roztoku (fyziol. roztok s přídavkem draselných a vápenatých iontů) pro nejlepší zachování původních struktur tkáně, pracuje se rychle a zároveň šetrně.
- Fixace. Ke konzervaci vzhledu tkáně se nejčastěji využívá chemické fixace, např. běžně pomocí 4-10 % roztoku formaldehydu. Lze ale využít i fyzikální fixace např. pomocí tepla (kmitání sklíčka s preparátem nad kahanem).
- Odvodnění a projasnění. Odvodnění vzorku se nejčastěji provádí vzestupnou alkoholovou řadou a k projasnění („zprůsvitnění“) tkáně se využívá např. xylenu.
- Zalévání. Nahrazení projasňovacího rozpouštědla zalévacím médiem, běžně pryskyřicí.
- Trimování a krájení. Opracování pryskyřicového bločku žiletkou pro odstranění přebytečné pryskyřice a následné krájení tenkých řezů (tloušťka 1–10 µm) na mikrotomu.
- Barvení. Působení barvicího reagens.
- Mounting. Tedy montování obarveného řezu na sklíčko do montovacího média, např. epoxidové pryskyřice nebo glycerolu (dle mísitelnosti preparátu s vodou) a přiložení krycího sklíčka.
- Prohlížení preparátu pod mikroskopem.
Mikroskopie v temném poli
-Jedná se speciální techniku, kdy do objektivu prochází pouze světlo lomené, ohnuté nebo odražené preparátem a světlo, které přímo prochází preparátem se nepodílí na výsledném obrazu. Toho je dosaženo za užití speciální kruhové clony, ta propouští pouze úzký obvodový prstenec světla. Obraz, který pak dostáváme je světlý objekt na tmavém poli, čímž je dosaženo dobrého kontrastu bez potřeby barvicích technik.
Polarizační mikroskopie
-Při této metodě se využívá polarizovaného světla, které interaguje s tzv. dvojlomnými strukturami (např. krystalické buněčné inkluze). Součástí mikroskopu jsou dva polarizační hranoly zvané polarizátor a analyzátor. Dvojlomné struktury rozdělí procházející polarizovaný paprsek vytvořený polarizátorem na dva – řádný a mimořádný. Tyto paprsky jsou proti sobě fázově posunuté a při jejich opětovném složení do jednoho paprsku v analyzátoru dochází k interferenci, díky čemuž se dvojlomné struktury jeví jako světlé na tmavém pozadí. Jednolomné struktury zůstávají tmavé (např. buněčné jádro, cytoplazma).
Mikroskopie s fázovým kontrastem
-Při mikroskopii fázového kontrastu lze také dosáhnout většího kontrastu v nebarveném preparátu. Světelné vlnění po průchodu preparátem mění totiž svoji fázi, různé světelné paprsky mají tak různou fázi vlnění. Tyto fázové rozdíly nelze lidským okem rozpoznat, ale pomocí mikroskopu s fázovým kontrastem ano, ten převádí fázové změny na amplitudové, které se pak jeví jako změny v intenzitě záření. Využívá se při tom speciální kondenzorová a fázová maska. Kondenzorová maska propouští úzký obvodový prstenec světla, toto světlo je pak různě rozptýleno preparátem, díky čemuž obchází tmavý prstenec fázové masky a prochází až do objektivu. Zjednodušené lze říct, že čím hustší preparát, tím větší rozptyl paprsků způsobí a tím většího kontrastu je dosaženo, výsledný obraz je tak mapou optické hustoty preparátu.
Fluorescenční mikroskopie
-Fluorescenční mikroskopie využívá speciálně uzpůsobeného světelného mikroskopu k pozorování fluoreskujících struktur. Na rozdíl od světelného mikroskopu obsahuje silnější zdroj světla, který je schopen excitace tzv. fluorochromů, často se jedná o laser. Dále obsahuje systém několika filtrů, těmi jsou excitační a emisní filtr a dichroické zrcadlo. Excitační filtr propouští na preparát pouze světlo o takové vlnové délce, které je potřeba k excitaci daného fluorochromu. Emisní filtr propustí do objektivu pouze záření o specifické vlnové délce emitované daným fluorochromem. Dichroické zrcadlo slouží jako interferenční filtr rozdělující světlo podle vlnové délky a oddělující tak excitační záření od emisního. Přidává se ke zdroji světla pod úhlem 45°. Fluorescenční mikroskopie je hojně využívána k detekci specifických sekvencí nukleových kyselin, různých bílkovin a jejich lokalizaci v buňce.
Konfokální mikroskopie
-Při konfokální mikroskopii je preparát snímán v několika optických rovinách, výsledný obraz je pak složen a je docíleno obrazu s maximálním rozlišením bez rušivého nezaostřeného pozadí. Uspořádání mikroskopu je podobné jako u fluorescenčního mikroskopu. Avšak zde laserové záření prochází speciální bodovou clonou propouštějící pouze jeho velmi úzký paprsek na preparát. Paprsek vycházející z preparátu pak do objektivu prochází přes další bodovou clonu, čímž je eliminován okolní šum a získáváme obraz pouze z jednoho malého bodu preparátu. Tímto způsobem se bod po bodu analyzuje celý preparát a počítačový software složí výsledný obraz. Díky tomu lze dokonce vytvořit trojrozměrný obraz preparátu. Konfokální mikroskop tak poskytuje jedny z nejkvalitnějších obrázků zkoumaných objektů.
Ultrafialová mikroskopie
-Ultrafialová mikroskopie využívá jako zdroj světla UV záření. To má kratší vlnovou délku než viditelné světlo a tak je dosaženo větší rozlišovací schopnosti. Protože UV záření není lidským okem pozorovatelné, používá se ke snímání obrazu CCD kamera.
Infračervená mikroskopie
-Infračervená mikroskopie využívá jako zdroj světla infračervené záření. Na rozdíl od viditelného světla proniká objekty lépe, takže se používá ke studiu silných preparátů nebo složitých směsí. Místo klasických skleněných čoček jsou zde sférická zrcadla (infračervené záření neprochází sklem) a obraz je zaznamenáván na citlivé fotodetektory.
———————————————————————————————————————————————————————————————————————————————————————————-
Elektronová mikroskopie
Do této podskupiny patří transmisní elektronová mikroskopie (TEM, z angl. transmission electron microscopy) a skenovací elektronová mikroskopie (SEM, z angl. scanning electron microscopy). Díky nižší vlnové délce elektronů v porovnání s fotony lze za užití elektronové mikroskopie dosáhnout mnohem většího zvětšení, což je hlavní výhoda oproti světelné mikroskopii. Bývá tak často využívána pro analýzu ultrastruktury vzorků. Dalším rozdílem mezi světelnou a elektronovou mikroskopií je, že zdroj světla je zde nahrazen elektronovým dělem, které emituje elektrony a namísto soustavy optických čoček je zde využito soustavy elektromagnetických cívek, které pomáhají usměrňovat svazek elektronů na vzorek. Aby nebylo proudění elektronů nikterak narušeno, musí být zajištěno uvnitř těla mikroskopu dokonalé vakuum. Elektrony jsou poté zachyceny detektorem a převedeny na výsledný obraz. Nevýhodou elektronové mikroskopie je potom náročné zpracování vzorku před samotným pozorováním (několik dní) a vysoké náklady (nejen na zpracování vzorku, ale i na přístrojové vybavení a jeho provoz).
Transmisní elektronová mikroskopie (TEM)
-Transmisní elektronová mikroskopie se využívá k analýze vnitřních struktur vzorku, jelikož jsou detekovány elektrony prošlé vzorkem. Obraz vzniká na fluorescenčním stínítku a je snímán speciální CCD kamerou. Limit maximální tloušťky preparátu činí 100 nm, protože tlustším preparátem by elektrony neprošly. Rozlišení transmisního mikroskopu je vůbec jedno z nejvyšších a činí 0.1 nm a zvětšení, kterého lze dosáhnout je až 800 000x. Ovšem příprava preparátu je značně náročná a trvá několik dní. Vzorek musí být nejprve dostatečně dlouho fixován, aby se zachovaly jeho struktury co nejvíce podobné nativnímu stavu. Předtím než je vzorek zalit do pryskyřice, musí být dokonale odvodněn, k tomu se používá vzestupná alkoholová řada. Po zatvrdnutí vzorku v pryskyřici lze provést přípravu ultratenkých řezů na ultramikrotomu. Získané řezy jsou pak pokládány na kovovou síťku (nejčastěji měděná) místo podložního skla jako tomu je u světelné mikroskopie, plošná velikost preparátu je tak limitována obsahem kovové síťky (normalizovaný průměr sítěk je 3 mm), přičemž elektrony mohou procházet pouze volnými otvory této síťky. Poté přichází na řadu kontrastování vzorku, k tomu se využívají sloučeniny těžkých kovů. Na konec bývá vzorek ještě impregnován tenkou vrstvou uhlíku, která zajistí jeho větší odolnost pod elektronovým svazkem.
Obvyklý postup při přípravě preparátu:
- Zpracování tkáně. Zkoumaná tkáň by měla být vypitvána co nejrychleji a zároveň co nejšetrněji a potom ihned uložena do fixačního roztoku, aby byly původní struktury zachovány co nejlépe. Zabrání se tak lytickému působení enzymů, které jsou tkáni vlastní. Pokud se jedná a příliš malé kousky tkání, lze je pro snažší manipulaci zalít do lehce zchladlého 2% agaru ve vodě před a nebo po fixaci. Ztuhlý agar pak rozkrájíme na kousky obsahující zkoumanou tkáň a manipulujeme v následovných krocích s nimi. Porézní struktura agarového gelu zajistí, že se veškeré reagencie dostanou dobře až ke tkáni.
- Primární fixace. Jako primární fixační agens se nejčastěji využívají aldehydy, např. glutaraldehyd. Ten proniká rychle do tkání, fixuje dobře proteiny, avšak hůře lipidy. Typicky se používá 2.5 % glutaraldehyd v 0.1 M pufru fosfátovém pufru. Příliš nízká koncentrace glutaraldehydu nemusí být pro správnou fixaci dostatečná a naopak příliš vysoká koncentrace je zbytečná. Klíčové je i pH, to by mělo být shodné s pH intracelulární kapaliny (obvykle pH 6.0-7.5). Dále potom délka inkubace fixované tkáně ve fixačním roztoku by měla být dostačující, primární fixace může probíhat i několik dní, sekundární fixace pak několik hodin. V neposlední řadě záleží také na objemu fixačního roztoku, ten by měl být klidně až 1000x větší než objem fixované tkáně, aby nedošlo k vyčerpání fixační látky ještě před skončením intervalu samotné fixace.
- Promytí vypíracím roztokem. Může se využít např. 0.1 M fosfátový pufr s 4 % glukózou (pH 7.4). Glukóza slouží k úpravě osmolarity roztoku na optimální hodnotu vzhledem k promývané tkáni.
- Sekundární fixace nebo také postfixace. Při té se využívá oxidu osmičelého (resp. 4 % roztok OsO4 v 0.1 M fosfátovém pufru), ten má silný oxidační účinek, stabilizuje lipidy, ale může dokonce až způsobit úplnou destrukci proteinových struktur ve zkoumané tkáni, proto se využívá až jako sekundární fixační agens. Navíc také zvyšuje kontrast tkání.
- Promytí vypíracím roztokem.
- Odvodnění vzestupnou etanolovou nebo acetonovou řadou.
- Přenesení tkáně do pryskyřice. Je prováděno postupným prosycováním tkáně pryskyřicí následovně – nejprve je tkáň vložena do roztoku 100% alkoholu (z předešlého kroku) a pryskyřice v poměru 2:1, poté do roztoku o shodném kvalitativním složení ale poměru 1:1, poté do roztoku o poměru 1:2 a nakonec do čisté pryskyřice. Pryskyřice musí být stabilní ve vakuu, odolávat elektronům a zároveň je na řezu nikterak vychylovat či pohlcovat, aby nedošlo k ovlivnění vznikajícího obrazu. Používají se epoxidové nebo akrylátové pryskyřice o různých tvrdostech.
- Tvrdnutí pryskyřice ve formičkách, trvá cca 24-48 hodin.
- Trimování a krájení. Trimování spočívá v přípravě malé pyramidky pryskyřicového bločku za užití jednorázové ostré žiletky ještě před samotným krájením ručně. Podstatou je zmenšení plochy bločku a odstranění přebytečné pryskyřice. Krájení je pak prováděno na automatickém ultramikrotomu s diamantovým nožem. Optimální tloušťka ultratenkých řezů se většinou pohybuje mezi 60-70 nm. Platí, že se snižující tloušťkou řezů se zvyšuje rozlišení výsledného obrazu, ale snižuje se kontrast. Někdy bývá za trimování vložen mezikrok přípravy polotenkých řezů (tloušťka 500 nm) za užití skleněného nože. Takto získané řezy jsou nabarvené toluidinovou modří (jedno ze základních histologických barviv, barví jádra modře) a prohlíženy pod světelným mikroskopem. Na základě tohoto pozorování je pak rozhodnuto, která část tkáně bude podrobena dalším krokům.
- Přenesení řezů na kovové síťky. Kovové síťky slouží jako nosiče vzorků, které jsou schopny odolat bombardování elektrony. Jsou vyrobeny nejčastěji z mědi, zlata nebo niklu. Normalizovaný průměr je 3 mm (dříve 2.3 mm) a uspořádání otvorů je různé – větší otvory dovolují pozorování větší plochy řezů, avšak hrozí nebezpečí prohnutí a roztržení řezu Manipulace se síťkami v následujících krocích probíhá výhradně pomocí pinzety,
- Kontrastování. Řezy na síťkách se kontrastují za užití sloučenin těžkých kovů. Využívá se kombinace uranylacetátu a lead citrátu (s mezikrokem promytí), které adherují na struktury vzorku a zajistí větší rozptyl elektronů a tedy i větší kontrast ve výsledném obrazu.
- Pouhlíkování. Naprašování tenké uhlíkové vrstvy na vzorky pro zvýšení jejich odolnosti ve vakuu pod elektronovým svazkem.
- Prohlížení preparátu mikroskopem.
![]() Vzhledem k velkému množství kroků při přípravě vzorku je velkým problémem vznik artefaktů, tzn. struktur, které neexistují v nativním stavu a mohou způsobovat chybné interpretace výsledků zejména u začátečníků v tomto oboru. Artefakty mohou vznikat při nesprávně zvolené fixáži (neprostupuje vzorkem, nedostatečná koncentrace, nesprávné pH a osmolarita), při kontaminaci sraženinami konstrastovacích roztoků apod.
Vzhledem k velkému množství kroků při přípravě vzorku je velkým problémem vznik artefaktů, tzn. struktur, které neexistují v nativním stavu a mohou způsobovat chybné interpretace výsledků zejména u začátečníků v tomto oboru. Artefakty mohou vznikat při nesprávně zvolené fixáži (neprostupuje vzorkem, nedostatečná koncentrace, nesprávné pH a osmolarita), při kontaminaci sraženinami konstrastovacích roztoků apod.
Skenovací elektronová mikroskopie (SEM)
-Skenovací, nebo také rastrovací, elektronová mikroskopie se využívá k analýze vnějších struktur vzorku, tedy jeho povrchu. Svazek elektronů postupně skenuje povrch preparátu, odražený (emitovaný) paprsek elektronů se pak převádí na výsledný obraz. Rozlišení skenovacího mikroskopu sahá maximálně k hodnotě 0.5 nm. Pro pozorování preparátů pod skenovacím elektronovým mikroskopem musejí vzorky být dokonale fixované, odvodněné/lyofilizované a jejich povrch musí být vodivý, proto jejich příprava zahrnuje také impregnaci vodivými kovy, a to nejčastěji zlatem, platinou nebo chromem. Kovový povrch musí dokonale kopírovat reliéf preparátu a zajistit co největší zisk odražených elektronů. Zpracovaný preparát je potom přilepen na kovový nosič a pozorován.
———————————————————————————————————————————————————————————————————————————————————————————-
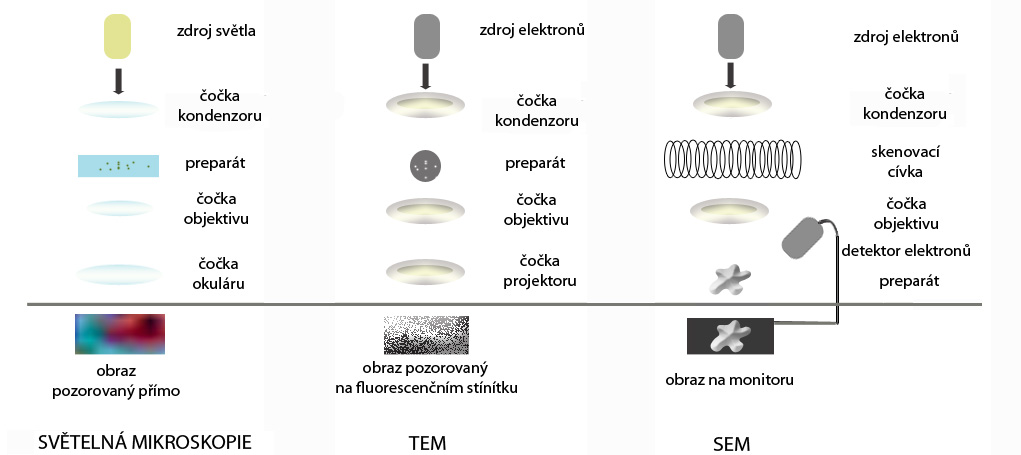
Obrázek: Zjednodušené schéma porovnávající uspořádání světelného a elektronového mikroskopu (TEM – transmisní, SEM – skenovací) pro shrnutí. U světelného mikroskopu je zdrojem záření žárovka, u elektronového mikroskopu je to žhavená katoda, která emituje elektrony (směr záření je naznačen šipkou). Čočky světelného mikroskopu jsou skleněné, zatímco u elektronového mikroskopu jsou čočky elektromagnetické, úkolem obou typů čoček je zajistit správný chod záření od jeho samotného zdroje. Pro správný chod elektronů je v těle elektronového mikroskopu navíc zapotřebí vakuum, u světelného mikroskopu nikoliv. Na světelném mikroskopu pozorujeme barevný obraz přímo, může se jednat i o živé objekty, u elektronového mikroskopu pozorujeme černobílý obraz vznikající buďto na fluorescenčním stínítku (TEM) a nebo na monitoru (SEM; zprostředkovává detektor odražených elektronů od preparátu) a jedná se vždy o usmrcené a dokonale odvodněné objekty.