Detergenty jsou skupina látek, které jsou schopny mezi molekulami v roztoku vytvářet hydrofilní/hydrofobní interakce. V biologickém výzkumu se detergenty využívají k lýzi buněk, rozrušení bipolárních lipidických buněčných membrán, pro uvolnění a rozpuštění membránově vázaných proteinů. Jsou také využívány pro stabilizaci, krystalizaci nebo denaturaci proteinů, snížení povrchového napětí, zvýšení mísitelnosti a stabilizaci emulzí či pro snížení nespecifických vazeb při afinitních purifikacích.
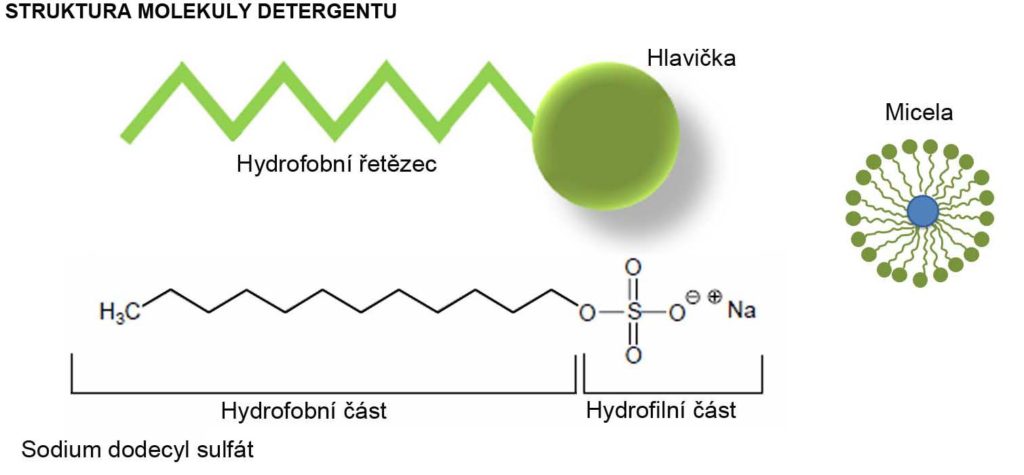
Detergenty jsou amfipatické molekuly, což znamená, že obsahují jak nepolární, tak polární část. Polární (hydrofilní) část je tvořena tzv. hlavičkou, nepolární (hydrofobní) část je tvořena řetězcem, který je alifatického nebo aromatického charakteru. Molekuly detergentu, pokud jsou přítomny v dostatečné koncentraci, se ve vodném roztoku svou polární hydrofilní částí váží k molekulám polárního rozpouštědla (molekuly vody), zatímco hydrofobní řetězce se váží k molekulám hydrofobních částic. To vede ke tvorbě vysoce organizovaných struktur označovaných jako micely. Tímto způsobem detergenty umožňují vznik stabilního propojení mezi hydrofilními a hydrofobními látkami v roztoku.
CHARAKTERISTIKY DETERGENTŮ
Důležitou charakteristikou detergentu je hodnota CMC (Critical Micelle Concentration, kritická koncentrace micel), která udává koncentraci detergentu v roztoku, při které dochází k formaci micel. Hodnota CMC je ovlivňovaná přítomností dalších složek v roztoku, například přídavkem soli, který tvorbu micel podporuje a tím snižuje hodnotu CMC.
Agregační číslo. Počet molekul detergentu, které formují micelu, je udáván agregačním číslem.
Hydrofilní-lipofilní rovnováha (HLB, hydrophile-lipophile balance) udává hydrofilní charakter detergentu. Detergenty s hodnotou HLB vyšší než 7 jsou více rozpustné ve vodném rozpouštědle než organickém rozpouštědle. HLB rovněž určuje, jestli je detergent denaturační nebo ne-denaturační. Detergenty s HLB mezi 12 až 16 jsou obvykle ne-denaturační, zatímco detergenty s s HLB vyšší než 20 jsou obvykle denaturační.
VYUŽITÍ DETERGENTŮ PŘI BUNĚČNÉ LÝZI A SOLUBILIZACI MEMBÁRNOVÝCH PROTEINŮ
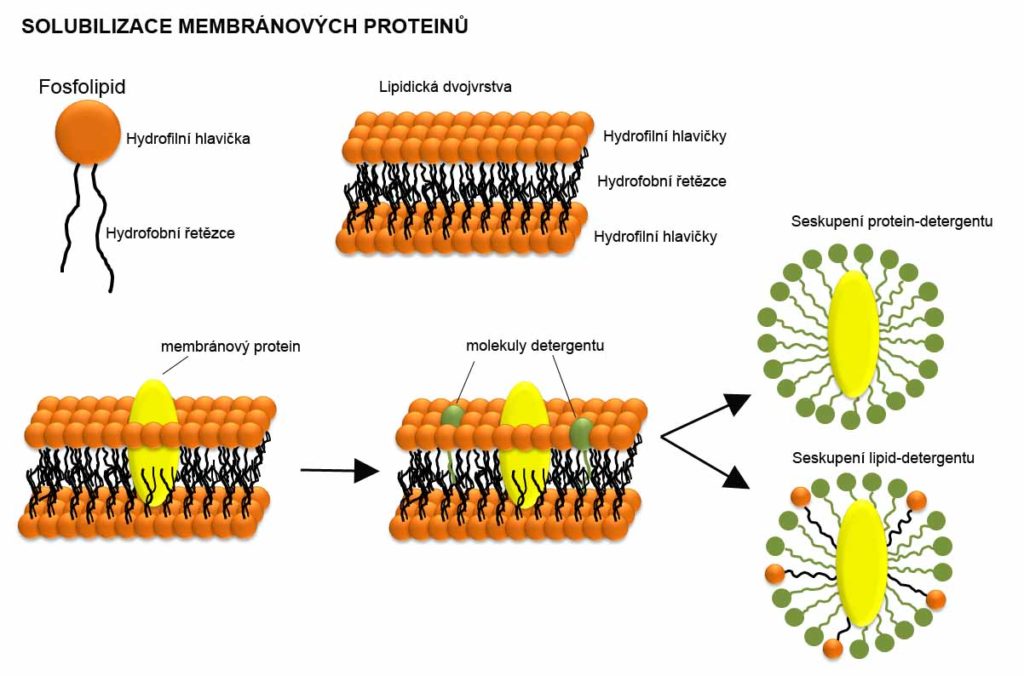
Detergenty jsou využívány k rozrušení biologických membrán a solubilizaci membránových proteinů, což je umožněno tím, že biologické membrány jsou tvořeny fosfolipidy, které jsou stejně jako detergenty amfipatické povahy. Fosfolipidy mají nabitou polární hlavičku, na kterou jsou napojeny dva hydrofobní řetězce. Fosfolipidy formují dvouvrstvu, která je tvořena interakcí hydrofobních řetězců umístěných mezi hydrofilními hlavičkami fosfolipidů. Pokud do roztoku s lipidickou membránou přidáme detergent, dochází k integraci molekul detergentu dovnitř membrány a molekuly detergentu se stávají součástí membrány. Pokud je koncentrace detergentu dostatečně vysoká (tzn. je vyšší nebo rovna hodnotě CMC), je membrána detergenty saturovaná a dochází k jejímu rozpadu a uvolnění proteinů do roztoku. Výsledkem jsou komplexy protein-detergentu a lipid-detergentu. Koncentrace detergentu pro solubilizaci membránových proteinů a buněčnou lýzi je 0,01 – 3%.
TYPY DETERGENTŮ
Iontový charakter polární hlavičky vede k rozlišení detergentů na několik typů: iontové (nesoucí náboj, buď aniontové nebo kationtové), neiontové (bez náboje), obojetné (zwitteriontové, nesoucí skupiny s pozitivním náboj a skupiny z negativním nábojem, ale celkový náboj je nulový).
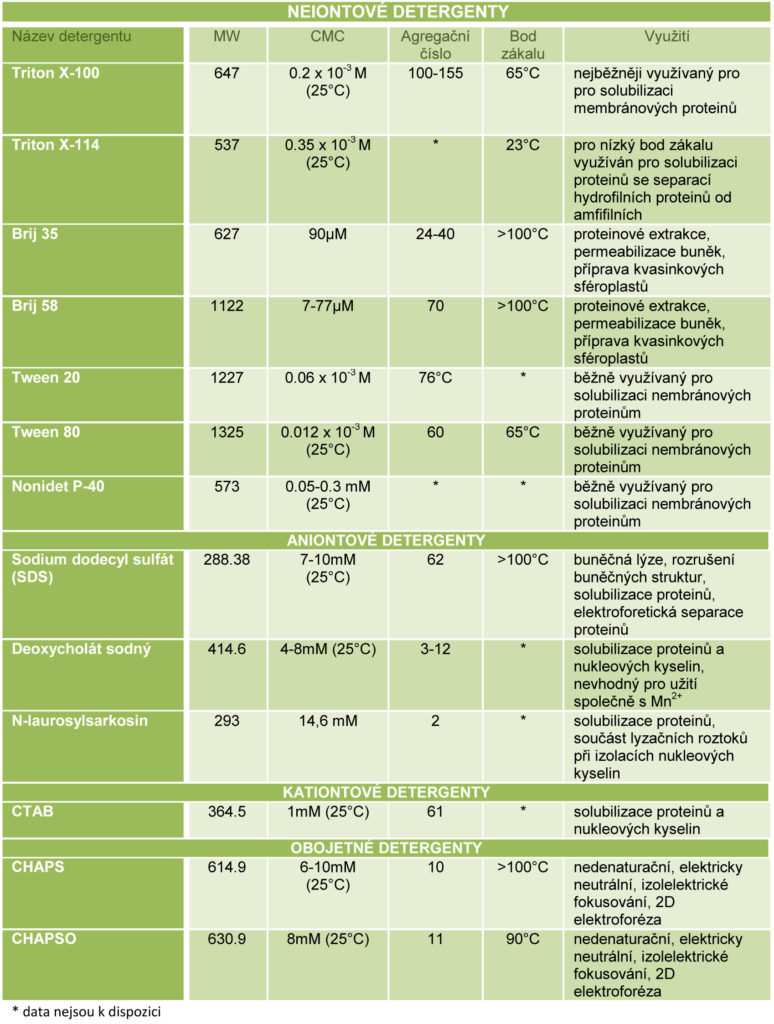
Iontové detergenty. Jsou považovány jako silné, denaturující detergenty. Hlavička iontových detergentů nese kladný nebo záporný náboj. Působením těchto detergentů většina proteinů ztrácí svou nativní strukturu, protože vlivem detergentů dochází k rozpadu sekundární, terciární a kvarterní struktury proteinu a rovněž dochází k rozrušení protein-proteinových interakcí. Působením iontových detergentů tedy dochází k denaturaci proteinů. Navázáním iontového detergentu na molekulu proteinu dochází k překrytí celkového náboje proteinu nábojem detergentu, tzn. detergent poskytuje proteinu svůj náboj. Lipid-proteinové interakce působením iontových detergentů nejsou ovlivněny. Příkladem iontových detergentů je sodium dodecyl sulfát (SDS). Iontové detergenty jsou využívány ke kompletnímu rozrušení buněčných struktur a denaturaci proteinů např. pro gelovou elektroforézu.
Neiontové detergenty. Neiontové detergenty nenesou náboj a fungují obecně jako mírné, nedenaturující detergenty. Ačkoliv solubilizují hydrofobní proteiny, mají omezené schopnosti narušovat protein-proteinové interakce. Neiontové detergenty ovšem narušují většinu lipid-lipidových interakcí a lipid-proteinových interakcí, rovněž u detergentů s krátkými hydrofobními řetězci může dojít k deaktivaci proteinů. K neiontovým detergentům patří Tween, Triton X-100, Igepal CA-630. Jsou často využívány k izolaci biologicky aktivních membránových proteinů.
Obojetné (zwitteriontové) detergenty. Obojetné detergenty spojují charakteristiky iontových a neiontových detergentů. Jsou méně denaturující než iontové detergenty a celkový náboj je nulový. Působením těchto detergentů je tedy zachován nativní stav protein a nedochází ke změnám v jejich přirozeném celkovém náboji. Obojetné detergenty jsou využívány při isoelektrickém fokusování a 2D elektroforéze.
ROZPUSTNOST DETERGENTŮ VE VODĚ
Rozpustnost detergentů ve vodě je závislá na chemickém složení, iontové síle prostředí, pH, přítomnosti selektivních iontů ve vodě, nejvýznamněji ovšem na teplotě. U iontových detergentů platí tzv. Kraftův bod. Pokud teplota klesne pod Kraftův bod, dochází k vysrážení micelární roztoku a tvorbě nerozpustných krystalů. Se zvýšením teploty na Kraftův bod a více naopak dochází k formaci micel. U neiontových detergentů se naopak rozpustnost snižuje se zvyšující se teplotou. Je to charakterizováno bodem zákalu, což je maximální teplota, při které neiontové detergenty formují micely a nad kterou dojde k vytvoření dvou fází v roztoku (tedy detergent „vypadne” z roztoku).
KRITÉRIA PRO VÝBĚR VHODNÝCH DETERGENTŮ
Při výběru vhodného detergentu se řídíme dle toho, jestli detergent:
• je denaturující (denaturuje strukturu proteinu) nebo ne-denaturující (zachovává nativní strukturu proteinu),
• ovlivní/neovlivní aktivitu proteinu,
• ovlivní/neovlivní následující experimentální proceduru – např. měly by být brány v potaz spektrální vlastnosti detergentů při přípravě extraktů pro kolonovou chromatografii či frakcionaci pomocí UV (např. Triton X-100 má významnou UV absorbanci při 280 nm, naproti tomu např. CHAPS v tomto ohledu nijak neinterferuje). Dalším příkladem je to, že iontové detergenty se nehodí v případech, ve kterých je vzorek využit pro iontově výměnnou chromatografii nebo isoelektické fokusování,
• je odstranitelný z výsledného extraktu a také jakým způsobem ho lze z extraktu odstranit.
Literatura:
Myers D. (2006) Surfactant Science and Technology. 3d ed. — N.Y.: Wiley–Interscience,. — 380 p.
Detergent Handbook & Selection Guide to Detergent & Detergent removal. G-Biosciences • 1-800-628-7730 • www.GBiosciences.com.
Seddon et al. (2004) Membrane proteins, lipids and detergents: not just a soap opera. Lipid-Protein Interactions. 1666 (1-2), 105–117p.
