Metoda byla v roce 2006 vytvořena firmou Solexa a poté odkoupena firmou Illumina. Základní schéma metody je:
• V prvním kroku je DNA fragmentovaná na úseky o velikosti 200 bp, konce chromosomů jsou zarovnány, fosforylovány a na 3’ konci adenylovány.
• Na konce vzniklých fragmentů jsou upevněny dva typy adaptérů, s cílem toho, aby každý fragment nesl na jednom konci jeden adaptér a na druhém konci druhý adaptér.
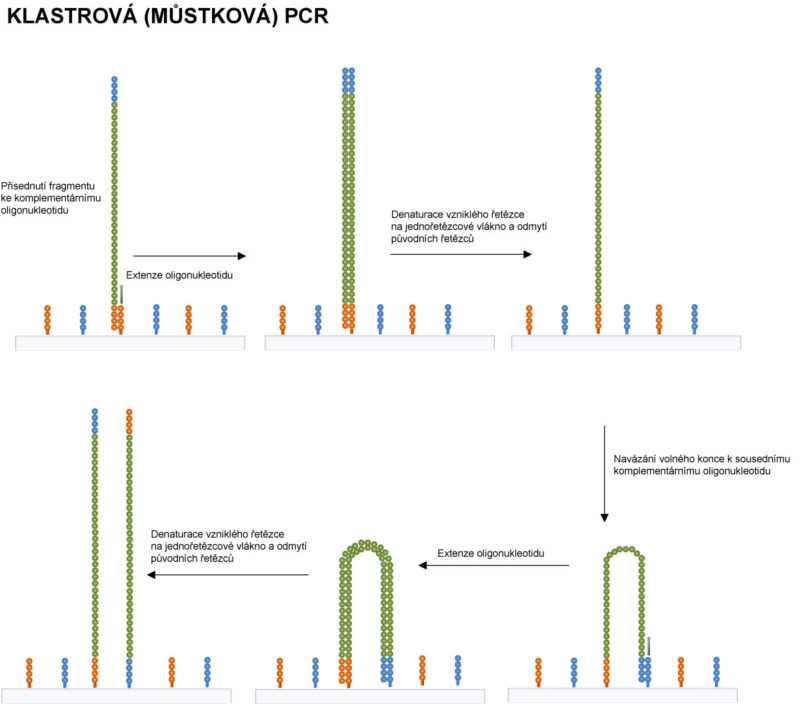
• Fragmenty s napojenými adaptéry jsou denaturovány a, jako jednořetězcové molekuly, jsou připojeny k jednořetězcovým oligonukleotidům, které jsou navázány na opticky transparentním povrchu reakční komůrky („flow cell“). Oligonukleotidy v reakční komůrce jsou komplementární k použitým adapterům a v následných amplifikačních krocích slouží jako primery.
• Po přídavku reagencií nezbytných pro PCR amplifikaci dochází podle navázané, templátové DNA imobilizovaných fragmentů k extenzi oligonukleotidů. Vzniklé dvouřetězcové molekuly DNA jsou denaturovány na jednořetězcové molekuly. Původní templátové molekuly jsou odmyty pryč a v komůrce zůstává pouze nově syntetizované vlákno, kovalentně vázané na povrchu komůrky.
• Při následném „annealingu“ dochází k navázání volného konce imobilizované molekuly DNA k sousednímu komplementárnímu oligonukleotidu (vznikají jednořetězcové můstky) a v dalším kole amplifikace, kdy je oligonukleotid prodloužen se vytváří se dvouřetězcový můstek. Dvouřetězcové molekuly jsou denaturovány na jednořetězcové, jejichž volné konce přisedají k volným oligonukleotidům. Celý proces se cyklicky opakuje.
• Přisedání molekul vždy k blízce položeným oligonukleotidům umožňuje to, že amplifikace probíhá v klastrech, tj. ve skupinách na destičce sousedících molekul. Jednotlivé klastry destičky produkují identické molekuly DNA.
• Tento způsob PCR je označován jako klastrová či také můstková PCR.
• Amplifikací vzniklé dvouřetězcové mosty jsou nakonec denaturovány a reverzní vlákna jsou chemicky odštěpena.
• Sekvenování probíhá pomocí sekvenačních primerů, které přisedají k sekvencím adapterů a postupným přidáváním čtyř nukleotidů značených různými fluorochromy a chemicky inaktivovanou 3’ – OH skupinou, což zaručuje, že v jednom cyklu je inkorporován pouze jeden nukleotid. Po začlenění detektor zachytí signál příslušného fluorochromu. Terminační značka a fluorochrom se odstraní a dochází k inkorporaci dalšího nukleotidu.
• V současnosti je v nabídce společnosti Illumina několik přístrojů o různé výkonnosti. MiSeq a Mi-SeqDx jsou nízko kapacitní sekvenátory určené pro sekvenování malých genomů, amplikonové sekvenování a cílené sekvenování vybraných oblastí genomů. MiSeqDx je díky svou spolehlivost doporučen pro in vitro molekulární diagnostiku. NextGen 500 je vysokokapacitní stolní sekvenátor vhodný pro analýzu celých genomů, exomů a transkriptomů. HiSeq2500 je ultra vysokokapacitní sekvenátor určený pro velké sekvenační analýzy ve specializovaných centrech a HiSeq X Ten je nejvýkonnější sekvenační platformou.
Použitá literatura:
Koubková L., Vojtěšek B., Vyzula R. (2014) Sekvenování nové generace a možnosti jeho využití v onkologické praxi. Klin Onkol 2014; 27 (Suppl 1): S61–S68.
