Přípravě roztoků je třeba věnovat velkou pozornost. Je to nejzákladnější činnost v laboratoři, od které se odvíjí všechny následné experimenty.
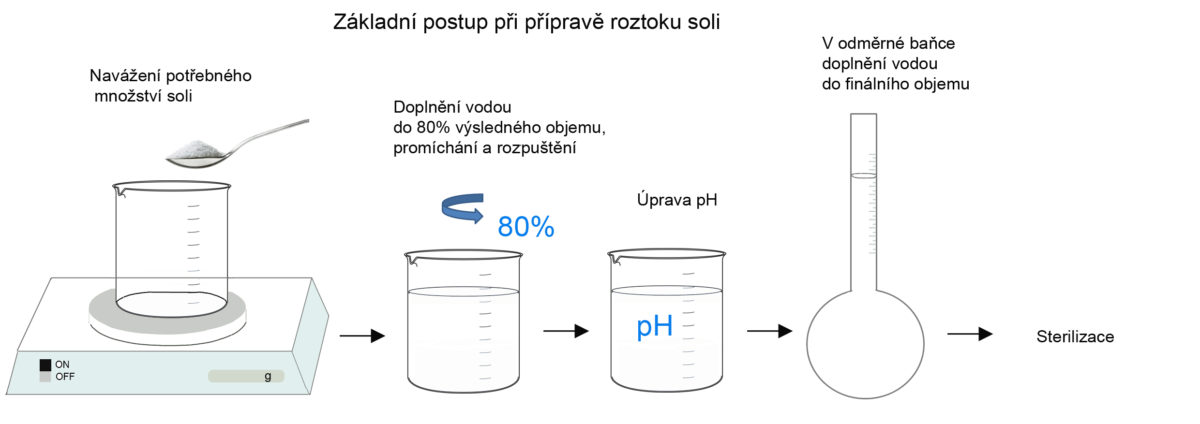
Příprava roztoků se provádí v několika krocích:
- Výpočet množství látky
- Rozpuštění látky
- Úprava pH
- Filtrace
- Sterilizace
- Příprava štítku láhve s připraveným roztokem
VÝPOČET MNOŽSTVÍ LÁTKY
Při výpočtu množství látky, které je třeba při přípravě roztoků použít, vycházíme z požadované koncentrace roztoku, případně u enzymů počítáme s jejich jednotkami. Koncentrace roztoku může být charakterizovaná několika způsoby. Nejčastěji se jedná o molární koncentraci a procentuální koncentraci.
1. MOLARITA (MOLÁRNÍ KONCENTRACE)
Molarita je nejčastější definicí koncentrace roztoku. Je označovaná jako „c“. Molarita je počet molů dané látky v jednom litru roztoku, proto se uvádí v jednotkách mol/l nebo mol/dm3 nebo také M (1 mol/l = 1 mol/dm3 = 1 M).
Počet molů je vyjádřen molární hmotností (MW), která udává hmotnost jednoho molu a vyjadřuje se v jednotkách g/mol.
Molarita je počítána ze vztahu:

Při přípravě roztoku, aby roztok měl určitou molární koncentraci (c) a určitý objem (V), je třeba vypočítat potřebné množství látky, které pro roztok použijeme. Pro výpočet použijeme tento vztah:

Údaj o molekulové hmotnosti dané látky (MW) je obvykle udávaný výrobcem na etiketě originálního balení či případně lze tento údaj vypočítat na základě relativních atomových hmotností (Ar) jednotlivých prvků sloučeniny, udaných v periodické tabulce.
Např. kyselina boritá H3BO3:
Ar (vodíku) …….1
Ar (bóru) ……..10
Ar (kyslíku) ….16
Molekulová hmotnost H3BO3 tedy je 3x 1 + 1x 10 + 3x 16 = 61 g/mol
Příklad: Připravte 800 ml (0,8 l) 0,5M NaCl.
Molární hmotnost NaCl je 58,45 g.mol-1. Potřebné množství NaCl je 58,45 x 0,8 x 0,5 M = 24 g.
Tedy, 24 g NaCl rozpustíme v 600 ml vody a získané množství doplníme do 800 ml.
Pro přípravu roztoku můžeme použít zásobní, tj. koncentrovaný roztok dané látky o určité molární koncentraci (M1). Molární koncentrace výsledného roztoku je M2, jeho objem V2.
Ze vztahu M1 x V1 = M2 x V2 vypočteme objem zásobního roztoku (V1), který je k přípravě potřeba dle vztahu. Objem může být vyjádřen jak v litrech, tak mililitrech (či dalších objemových jednotkách).
Příklad: Připravte 100 ml 0,1M NaCl ze zásobního roztoku 5 M NaCl
V2 = 100 x 0,1/5 = 2 ml
Tedy, doplňte 2 ml zásobního roztoku vodou do 100 ml.
2. PROCENTUÁLNÍ KONCENTRACE
Procentuální koncentrace vyjadřuje počet dílů látky rozpuštěných ve 100 dílech roztoku. Používají se tři základní vyjádření:
Hmotnostní procenta (w/w) jsou definována jako množství látky (v gramech) ve 100 g výsledného roztoku. Tj. hmotnost látky ku výsledné hmotnosti.
Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku.
Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku. Tj. objem látky ku výslednému objemu.
Příklad: Příprava 10 % (v/v) etanolu. 10 ml etanolu je doplněno vodou do 100 ml.
Hmotnostně-objemová procenta (w/v %) jsou definovaná počtem gramů látky na 100 ml výsledného roztoku. Tj. hmotnost látky ku výslednému objemu.
Příklad: Příprava 1 % (w/v) NaCl. 1 g NaCl je rozpuštěn a doplněn vodou do objemu 100 ml.
3. POČET JEDNOTEK (U) V URČITÉM OBJEMU
Je využíváno u enzymů. Při výpočtu postupujeme dle údajů daných výrobcem.
Výpočet molární koncentrace z procentuální koncentrace:
Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě. Hustota látky vyjadřuje hmotnost objemové jednotky látky a značí se jako ρ [ró]. Je definována jako podíl hmotnosti (m) a objemu tělesa (V), tzn. ρ=m/V.
Při výpočtu postupujeme následovně:
- Určíme hmotnost látky, která je v celkovém objemu daného roztoku, ze vztahu m (g) = V x ρ. Výsledek přepočítejte dle procentuální koncentrace daného roztoku.
- Vypočtěte molární koncentraci dle M = m (g)/ MW (g/mol) x V (l)
Příklad: Vypočtěte molaritu 37,2% HCl (hustota HCl je 1,19 g.ml-1 a molární hmotnost 36,4 (g/mol)
Hmotnost HCl v daném roztoku….. m = 1 ml x 1,19 g.ml-1 x 0,372 = 0,443 g.ml-1 = 443 g.l-1
Molární koncentrace …. M = 443 g / 36,4 g.mol-1 = 12,17
———————————————————————————————————————————————————————————————————————————————————————————–
ROZPUŠTĚNÍ LÁTKY
Pro přípravu roztoků využíváme přečištěnou, demineralizovanou vodu. Běžná voda obsahuje příměsi jako koloidní částice, rozpuštěné organické a anorganické látky, rozpuštěné plyny, mikroorganismy a DNA. Přečištění a především demineralizace vody je dosahováno většinou destilací či deionizací. Při přípravě roztoku rozpouštěnou látku rozpustíme v cca 80 % finálního objemu, upravíme pH a doplníme na finální objem. K rozpouštění se používají magnetická míchadla. Pro zdárné rozpuštění některých solí je nutné určité pH, příkladem je EDTA, která se rozpouští za přítomnosti NaOH.
Voda zbavená nečistot, iontů a mikroorganismů je známá také pod termínem ultračistá voda (purified water).
Způsoby purifikace vody:
- destilace – voda je zahřívána k bodu varu, vzniklá pára po průchodu chladičem kondenzuje na destilovanou vodu. Destilovaná voda je zbavena všech pevných částic, iontů, stejně tak i bakterií a virů.
- deionizace – metoda využívá schopnosti některých makromolekulárních látek, tzv. ionexů či iontoměničů, zachycovat ionty z roztoku. Deionizací nejsou odstraňovány nenabité organické látky, viry a bakterie.
- membránová filtrace (reverzní osmóza, nanofiltrace) – metoda sloužící k oddělení anorganických solí a menších organických látek pod tlakem. Používá se polopropustná membrána, která propouští vodu, ale ne rozpuštěné látky. Odstraňují se částice a ionty o velikosti jednotek nanometrů.
- filtrace – separace složek směsi, které mají částice větší, než je průměr póru filtru. Filtry odstraňují volný chlór, chloramin, oxid chloričitý, fenoly, organická rozpouštědla a pesticidy. Jako filtr slouží nejčastěji aktivní uhlí, které má omezenou životnost a po určitém čase musí být vyměněno nebo regenerováno. Pro odstranění mikroorganismů z vody se používají filtry s absolutní porozitou 0,22 µm.
- sterilizace UV zářením.
- další způsoby úpravy vody jako DEPC působení pro inaktivaci RNáz, …
———————————————————————————————————————————————————————————————————————————————————————————
ÚPRAVA pH. pH je upravováno jen u určitých roztoků. Pro úpravu pH používáme nejčastěji pH metr, případně pH papírky. pH upravujeme většinou pomocí 1 M NaOH nebo 1 M HCl. pH se upravuje v přibližně 80 % výsledného objemu. Takže pokud máme připravit 1 l roztoku, chemikálii nejprve rozpustíme v takovém množství vody, aby objem měl 0,8 l. Upravíme pH na požadovanou hodnotu a roztok doplníme na 1 l.
——————————————————————————————————————————————————————————————————————————————————————————-
STERILIZACE. Sterilizaci nejčastěji provádíme autoklávováním a někdy filtrací (např. roztok BSA by se autoklávováním zničil). Láhev s roztokem může být opatřena sterilizační páskou, která indikuje, že roztok byl vysterilizován autoklávem.
——————————————————————————————————————————————————————————————————————————————————————————-
ŠTÍTEK S POPISKEM. Láhev s roztokem se řádně označí štítkem, který uvádí název roztoku, koncentraci, datum a případně jméno toho, kdo roztok připravil.
——————————————————————————————————————————————————————————————————————————————————————————-
ZÁSOBNÍ ROZTOKY. Z praktického hlediska je v laboratoři výhodné mít sérii základních tzv. zásobních roztoků. K těmto roztokům patří především 1 M HCl, 1 M NaOH, 1 M (příp. 5 M) NaCl, 1 M Tris-HCl (pH 7), 1 M Tris-HCl (pH 8), 0,5 M EDTA (pH 8), 3 M Na-acetát, 100x TE pufr, 50x TAE pufr, 20x SSC.
Zásobní roztoky se využívají k přípravě následných, tzv. pracovních, roztoků či roztoků o nižší koncentraci.
——————————————————————————————————————————————————————————————————————————————————————————–
UCHOVÁVÁNÍ CHEMIKÁLIÍ. Zakoupené chemikálie je třeba uchovávat dle pokynů uvedených na obalu. Většina chemikálií (organické a anorganické látky) a většina připravených roztoků se uchovávají v pokojové teplotě (v angličtině označováno jako RT –„room temperature“). Některé roztoky či chemikálie vyžadují teplotu okolo 4 oC, tedy uskladnění v ledničce, velká část chemikálií a roztoků (většinou enzymy, protilátky) se skladují v -20 oC, tedy mrazničce. Ve speciálních případech, jako jsou kompetentní buňky či dlouhodobé skladování RNA, se vyžaduje teplota okolo -80 oC. Při uchovávání chemikálií je rovněž třeba brát zřetel na bezpečnost, tj. nikdy neskladovat např. žíravé či jinak nebezpečné chemikálie nad výškou našich očí, ale preferenčně vždy co nejníže.
——————————————————————————————————————————————————————————————————————————————————————————–
STERILITA A ČISTOTA PROSTŘEDÍ. U velké části experimentů je vyžadováno sterilní prostředí, čehož je získáváno používáním jednorázového laboratorního plastu, jako např. pipetovacích špiček a zkumavek. Laboratorní plast může být zakoupen již ve sterilní formě, případně může být sterilizován v laboratoři. Ke sterilizaci laboratorního plastu a skla je využíván autokláv. Při experimentech se zásadně nosí laboratorní rukavice, vhodný je i laboratorní oděv, nejlépe plášť. Nošením rukavic a laboratorního oděvu nechráníme jen naše experimenty, ale v mnoha případech také naše zdraví! V laboratoři zachováváme čistotu a řád laboratoře, pravidelně laboratoř uklízíme a stíráme laboratorní stoly. Zanedbaná a špinavá laboratoř představuje výrazné ohrožení jak našich experimentů, tak našeho zdraví. Přednostně vždy dbáme na naši vlastní bezpečnost a bezpečnost našich kolegů.
