Hybridizační techniky jsou využívány k detekci cílových genů. Existuje několik způsobů využití hybridizace, ale všechny tyto způsoby jsou variacemi na jedno téma.
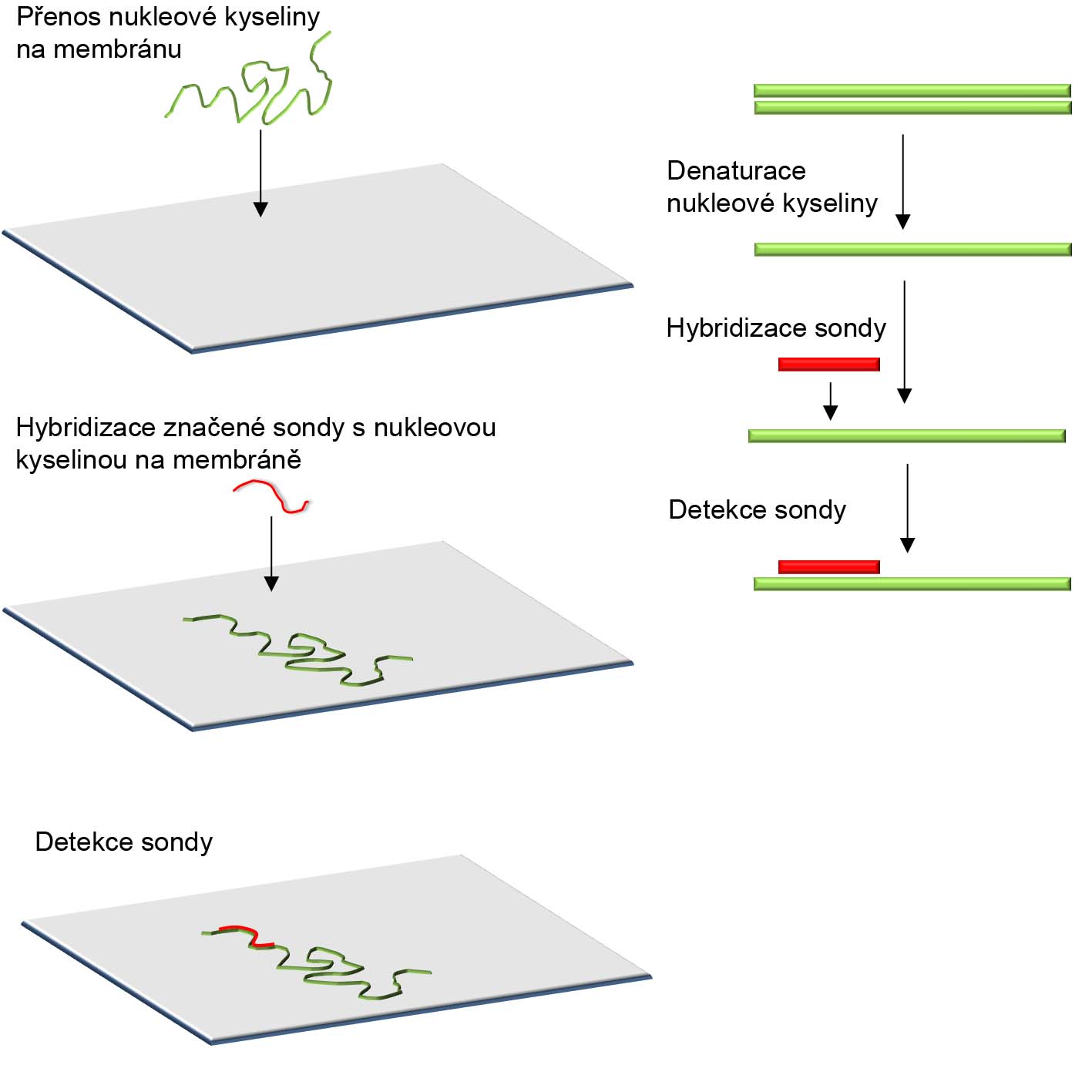
Základním principem těchto metod je hybridizace DNA či RNA, tj. vzájemné párování jednořetězcových molekul DNA či RNA. Párování jednořetězců nukleových kyselin je dáno komplementaritou bází, tzn. formací vodíkových vazeb mezi adeninem a tyminem (případně uracilem u RNA) a vodíkových vazeb mezi guaninem a cytosinem. Na základě komplementarity dochází k přisedání jednoho jednořetězcového úseku nukleové kyseliny k druhému a výsledné formaci dvouřetězcové molekuly.
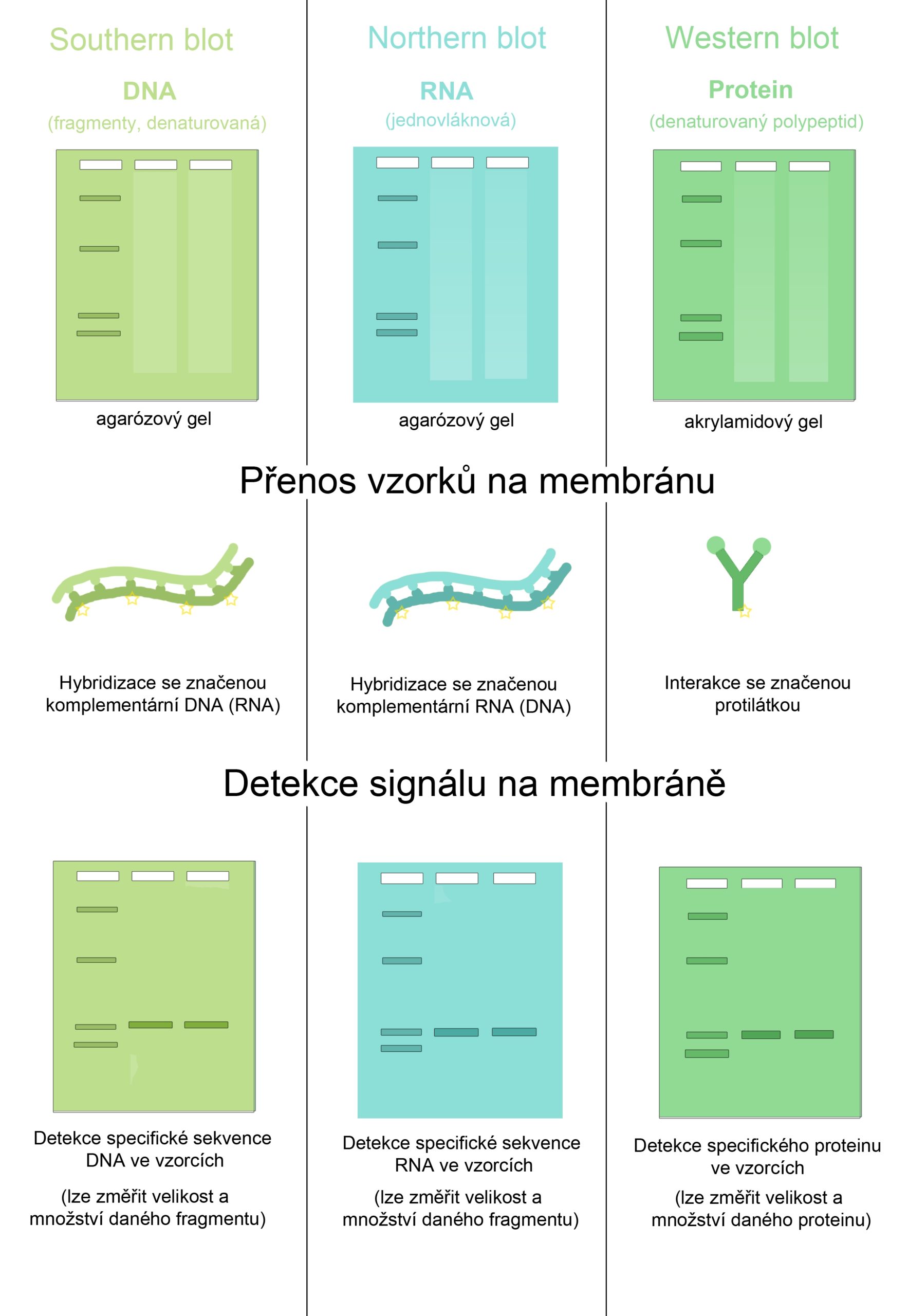
Při hybridizačních technikách je testovaná molekula nukleové kyseliny chemicky či teplem denaturována (z dvouřetězcové molekuly vznikají dvě jednořetězcové) a v této denaturované formě je nanesena na membránu. Vzorek nukleové kyseliny imobilizovaný na membráně je následně hybridizován se značenou sondou, která umožní vizualizaci hledané molekuly.
————————————————————————————————————————————-————————————————————————————————————————————-
MEMBRÁNA. Pro imobilizaci nukleové kyseliny jsou využívány membrány nylonové, nitrocelulosové nebo polyvinyliden difluoridové (PVDF), a u každé z nich jsou dostupné další typy s různými specifikami. Volba druhu membrány se odvíjí od způsobu detekce sondy, tj. doporučení výrobce daného systému. V současné době se nejčastěji používají pozitivně nabité nylonové membrány.
————————————————————————————————————————————-————————————————————————————————————————————-
HYBRIDIZAČNÍ SONDA. Jako sonda je využívaná nukleová kyselina, která je komplementární k sekvenci testované molekuly. Sonda je značená, a to buď radioaktivně či neradioaktivně. Sonda může být přímo ve formě jednořetězcové molekuly či může být i jako dvouřetězcová. Pokud je jako sonda využívaná dvouřetězcová molekula, je nutné ji před použitím denaturovat.
Jako hybridizační sondy jsou využívány:
• dvouřetězcové molekuly DNA
• jednořetězcové molekuly DNA
• molekuly RNA
• syntetické oligonukleotidy
Dvouřetězcové DNA sondy
Jako hybridizační sonda může být využita jakákoliv dvouřetězcová molekula DNA získaná např. zaklonováním do klonovacího vektoru nebo pomocí PCR. Značení dvouřetězcových sond se provádí pomocí:
• nick-translace pomocí komerčně dostupných kitů
• primer extension pomocí komerčně dostupných kitů
• PCR
Jednořetězcové DNA sondy
Jednořetězcové DNA sondy mohou být syntetizovány z mRNA použitím reverzní transkriptázy nebo z fragmentů klonovaných do specializovaných M13 nebo fagemidových vektorů, které obsahují místo počátku replikace jednořetězcové bakteriofágní DNA. Využitím radioaktivně značených 32P při syntéze vzniká radioaktivně značená sonda. Využití jednořetězcové DNA sondy na rozdíl od dvouřetězcových sond eliminuje riziko re-asociace denaturovaných jednovláknových molekul sondy.
RNA sondy
RNA sondy jsou získávány ze zaklonovaných fragmentů v klonovacích vektorech. Tyto vektory obsahují promotorové sekvence z bakteriofágů SP6 nebo T7, které přiléhají ke klonovacímu místu. Transkripce klonovaných úseků v přítomnosti rNTP značených 32P dává vznik značené RNA sondě. Templátová DNA je odstraněna jednoduchým štěpením DNázou. RNA sondy mají mnohé uplatnění, ovšem jejich velkou nevýhodou je riziko degradace RNA při kontaminaci RNázami.
Syntetické oligonukleotidy jako sondy
Syntetické oligonukleotidy mohou být připraveny mnohými komerčními firmami. Značení se provádí pomocí koncového značení, např. T4 DNA polymerázou.
————————————————————————————————————————————-————————————————————————————————————————————-
RADIOAKTIVNÍ VERSUS NERADIOAKTIVNÍ ZNAČENÍ SOND. Standardně se využívají sondy značené radioaktivně prostřednictvím 32P. V posledních letech je ovšem zvyšující se zájem o neradioaktivní značení jako především značení digoxigeninem (DIGem) nebo biotinem. Při neradioaktivním značení jsou sondy detekovány pomocí protilátky s navázanou např. alkalickou fosfatázou. Alkalická fosfatáza reaguje s přidaným substrátem jako např. NBT / BCIP (nitro blue tetrazolium/5-bromo-4-chloro-3-indolyl-phosphate) s výslednou kolorimetrickou či chemiluminiscenční reakcí. V porovnání s radioaktivním značením je neradioaktivní značení nepopíratelně výhodnější co do bezpečnosti a stability, ale na druhou stranu je mnohem méně citlivé.
————————————————————————————————————————————-————————————————————————————————————————————-
STRINGENCE (STRINGENCITA). Podmínky hybridizace určují tzv. stringencitu. Stringencita udává, v jaké intenzitě bude docházet k formaci hybridních molekul nebo naopak do jaké míry se budou hybridní molekuly rozpadat. Čím vyšší stringencita (stringentnější podmínky), tím bude vznikat méně hybridních molekul a naopak více hybridních molekul se bude rozpadat na jednořetězcové molekuly. A naopak to platí při nižší stringencitě. Míra stringencity je daná v podmínkách hybridizace i následném posthybridizačním promývání. Jedná se především o teplotu a koncentraci iontů, které udávají, do jaké míry dochází k hybridizaci, jestli dochází k hybridizaci specifické (pouze mezi komplementárními bázemi) či již nespecifické (mezi nekomplementárními bázemi). Se zvyšující se teplotou a snižující se koncentrací solí vzrůstá stringence a klesá pravděpodobnost nespecifické hybridizace. Pokud jsou podmínky příliš stringentní, nedochází již ani k hybridizaci specifické. Se stringencí souvisí teplota tání dvoušroubovice a teplota hybridizace.
————————————————————————————————————————————-————————————————————————————————————————————-
TEPLOTA TÁNÍ DVOUŠROUBOVICE A TEPLOTA HYBRIDIZACE. Teplota tání dvoušroubovice (Tm) souvisí s teplotou hybridizace a naopak.
Teplota tání je ovlivněna:
• Koncentrací monovalentních kationtů (M)
• Složením sekvence (procentuelním zastoupením GC párů či naopak AT párů)
• Délkou molekuly, tj. počtem bází (L)
• Množstvím formamidu v reakci (F)
Teplotu tání u sond delších než 50 nukleotidů lze vypočítat dle:
Tm = 81,5 °C + 16,6 logM + 0,41 (%G+C) – 0,61 (%F) – 500/L
Hybridizační teplota je o 25 °C nižší než je teplota Tm.
Pro ilustraci, v reakci, která je prováděna v roztoku 6X SSC, bez formamidu, s 50% GC obsahem a délkou sondy 500 bp, Tm je 101 °C a hybridizační teplota 75 °C.
Pokud nahradíme 6X SSC roztokem 1X SSC, dochází k redukci teploty o 13 °C. Pokud dále zahrneme 50% formamid, dochází ke snížení o dalších 30,5 °C. Kratší délka sondy (50 bp) redukuje Tm o dalších 10 °C.
V praxi ovšem není třeba počítat Tm pro každý experiment, protože standardní hybridizační podmínky fungují všeobecně dost dobře.
Teplota tání u krátkých sond (< 50 bp) je mnohem nižší než u těch delších. Tm krátkých sond lze vypočítat dle:
Tm = 2x (počet AT párů) + 4x počet GC párů
Hybridizační teplota je o 5 °C nižší než je Tm.
Obecně, hybridizace se provádí při nižší stringenci, vyšší stringenci používáme při promývacích krocích.
————————————————————————————————————————————-————————————————————————————————————————————-
PODMÍNKY HYBRIDIZACE
Teplota. Hybridizační teplota je nejkritičtějším faktorem, který ovlivňuje tvorbu vodíkových vazeb mezi řetězci DNA. Se zvyšující se teplotou se zvyšuje stringence.
Koncentrace iontů. Zvyšování koncentrace monovalentních kationtů umožňuje řetězcům DNA jejich snadnější vzájemné párování.
Složení bází. Na spárování G-C bází se podílí tři vodíkové vazby, na spárování A-T pouze dvě. Sondy bohaté na G-C tedy hybridizují mnohem efektivněji než sondy bohaté na A-T páry, ovšem také mnohem méně specificky. Proto by sonda měla být, co se týče G-C a A-T obsahu, vyvážená a měla by obsahovat 50-60% G-C.
Formamid. Formamid funguje jako destabilizující činidlo, které redukuje formaci vodíkových vazeb. Hybridizace s použitím formamidu je proto prováděna při nižších teplotách.
Délka sondy. Dlouhé sondy hybridizují pomaleji než krátké sondy.
Dextran sulfát. Dextran sulfát funguje jako urychlovač hybridizace. Dextran sulfát vytěsňuje molekuly sondy od zbytku hybridizačního roztoku a tím zvyšuje koncentraci sondy.
Blokovací látky. Např. sonikovaná DNA lososích spermií, Denhardtův roztok. Blokovací látky se váží na membránu a vyvazují místa, na která by se sonda vázala nespecificky.
Detergenty. SDS zvyšuje stringencitu hybridizace a rovněž funguje jako blokovací látka.
pH. Pro optimální výsledky by měla být hybridizace prováděna při pH 5 – 9.
Tetrametyl amonium chlorid (TMAC). A-T páry jsou mnohem méně stabilní než páry G-C. TMAC při koncentraci 3 M posouvá teplotu tání A-T párů k teplotě tání G-C párů. Toho lze využít při stanovování hybridizační teploty u krátkých sond, kde se s využitím TMAC hybridizační teplota odvíjí pouze od délky sondy a ne délky sondy a obsahu G-C.
————————————————————————————————————————————-————————————————————————————————————————————-
VYUŽITÍ HYBRIDIZACE
Dot/Slot Blot hybridizace: vzorek neseparovaných molekul DNA či RNA je imobilizován na membránu a poté sondou detekován.
Colony/Plaque Blot hybridizace: na membránu je přenesena DNA z kolonií baktérií či plaků bakteriofágů přímo z kultury.
Southernova/Northernova hybridizace: vzorek DNA/RNA je nejprve separován elektroforetickou separací a poté přenesen z gelu na membránu. Northern blot a Northernova hybridizace jsou ekvivalenty k Southern blotu a Southernově hybridizaci, jen místo DNA je detekovaná RNA.
————————————————————————————————————————————-————————————————————————————————————————————-
