Northernova hybridizace (či také Northernův blot) je metoda využívaná k detekci molekuly RNA, obvykle ke zjištění její přítomnosti, velikosti či množství.
Základním principem je hybridizace RNA, tj. vzájemné párování jednořetězcových molekul RNA, ke kterému dochází na základě komplementarity mezi bázemi hybridizovaných molekul (více info zde: Hybridizační metody – LabGuide.cz (posunemevasvys.cz).
V základním postupu je Northernova hybridizace stejná jako Southerova hybridizace. Nicméně vzhledem k tomu, že se při Northernově hybridizaci pracuje s RNA a ta je extrémně citlivá na působení RNáz, je zapotřebí se vyvarovat jakékoliv kontaminace RNázami. Pro snížení rizika kontaminace RNázami všechny roztoky, které jsou použity pro Northernovu hybridizaci, musí být ošetřeny dietylpyrokarbonátem (DEPC), který RNázy inaktivuje. Pokud se vyskytne kontaminace RNázami v průběhu experimentu, buď ve formě používaných roztoků či přítomnosti RNáz přímo ve vzorku, zvyšuje se nebezpečí degradace vzorku RNA.
DEPC (dietylpyrokarbonát) je používán k inaktivaci RNáz, a to prostřednictvím modifikací, které u těchto enzymů vytváří na histidinu, lysinu, cysteinu a tyrosinu.
• Pro inaktivaci RNáz se využívá 0,1% DEPC (v/v). Ve vodných roztocích DEPC rychle hydrolyzuje na CO2 a etanol. Poločas rozpadu DEPC je ve fosfátovém pufru při pH6 asi 20 min. Tato hydrolýza je zesilovaná roztokem Tris a dalších aminů, proto působení DEPC není doporučované za přítomnosti těchto látek. DEPC, který je uchováván bez přítomnosti nukleofilních látek (např. H2O nebo etanol) je perfektně stabilní, nicméně přítomnost i malého množství těchto látek vede k rychlému rozpadu DEPC. Proto je třeba DEPC chránit před vlhkostí. Uchovávejte DEPC v malých alikvotech a suchu. Před otevřením nechte vždy nádobu s DEPC vytemperovat na teplotu prostředí.
• Ošetření roztoků 0,1% DEPC: 1 ml DEPC přidejte k 1 litru roztoku, nechte působit alespoň 1 hodinu při 37 oC a poté DEPC inaktivujte autoklávováním. Při autoklávování se DEPC rozkládá na etanol a CO2. Pokud v roztoku zůstanou zbytky DEPC, může dojít k některým modifikacím RNA a inaktivací některých biochemických reakcí.
——————————————————————————————————————————–——————————————————————————————————————————–
PŘÍPRAVA ELEKTROFORÉZY
Umyjte elektroforetickou vanu, vanička a hřeben roztokem saponátu, opláchněte vodou, poté etanolem a vysušte. Poté ponořte do roztoku 3% H2O2 a nechte působit 10 min. Důkladně opláchněte v DEPC-H2O.
Příprava denaturačního gelu s 2,2 M formaldehydem:
RNA je ve formě jednořetězcových molekul, které tak hybridizují samy se sebou a vytváří tak více či méně složité sekundární struktury. Vzhledem k tomu, že tyto struktury mohou ovlivnit elektroforetickou separaci, je třeba molekuly RNA denaturovat. Denaturace se provádí v průběhu elektroforézy, a to prostřednictvím dodaného formaldehydu.
Příprava 100 ml agarosového gelu s 2,2 M formaldehydem:
• přidejte 1,5 g agarosy do 72 ml sterilní vody a rozpusťte v mikrovlnné troubě,
• nechejte ochladit na 55 oC,
• v digestoři přidejte 10 ml 10x MOPS elektroforetického pufru a 18 ml deionizovaného formaldehydu. Promíchejte a nalije do připravené elektroforetické vaničky.
1,5% agarosový gel je vhodný pro separaci RNA o velikosti 0,5 – 8 kb. Větší RNA by měla být separovaná v agarosovém gelu o koncentraci 1 – 1,2%.
Příprava 10X MOPS elektroforetický pufru:
• rozpusťte 41,8 g MOPS v 700 ml sterilní DEPC vody,
• upravte pH na 7,0 pomocí 2 M NaOH,
• přidejte 50 ml 1 M octanu sodného (s působením DEPC) a 40 ml 0,5 M EDTA (s působením DEPC), pH 7,
• doplňte objem roztoku na 1 litr pomocí DEPC vody.
Sterilizujte roztok pomocí filtrace přes 0,45 μm Milipore filtry a uchovávejte při pokojové teplotě chráněné před světlem. Pokud roztok časem změní barvu na tmavší než je slámově žlutá, nelze ho dále používat.
——————————————————————————————————————————–——————————————————————————————————————————–
VZORKY RNA A RNA VELIKOSTNÍ MARKER
• Množství celkové RNA, které je nanášeno na jednu jamku by obvykle mělo být do 20 μg v objemu 1-2 μl. Nanesení většího množství RNA do jamky vede k vytvoření šmouhy na gelu místo ostrého proužku.
• Pro správné odhadnutí velikosti separované RNA je třeba nanést i RNA velikostní marker. Molekuly DNA a RNA, ač stejné velikosti, neběží při ELFO stejně.
• Vzorky RNA jsou smíchány s denaturační směsí. S denaturační směsí je smíchán i velikostní marker.
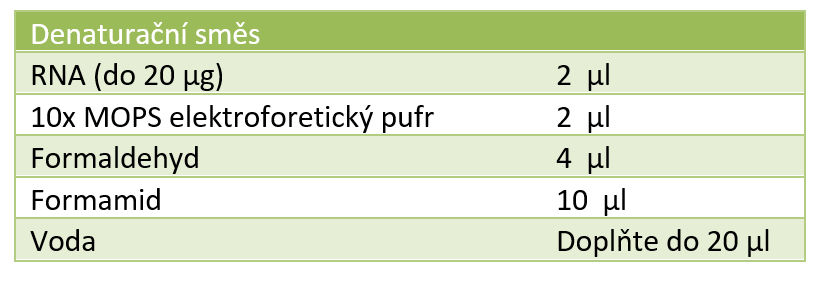
• Inkubujte vzorky 60 min, při 55 oC. Zchlaďte vzorky na ledu, 10 min a krátce centrifugujte.
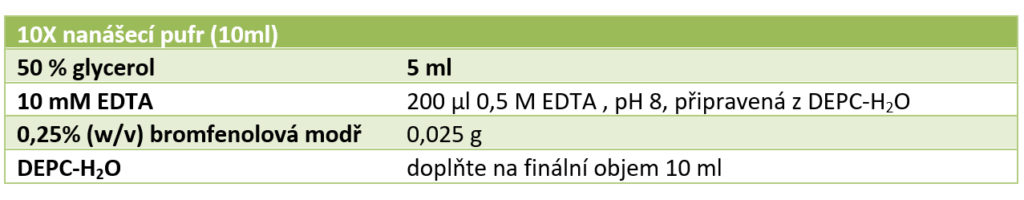
• Ke každému vzorku přidejte 2 μl 10x nanášecího pufru a uložte na led.
——————————————————————————————————————————–——————————————————————————————————————————–
ELEKTROFORETICKÁ SEPARACE RNA
• Připravte elektroforézu, vložte připravený gel a zalijte dostatečným množstvím 1x MOPS elektroforetickým pufrem. Nechte elektroforézu běžet nejprve bez vzorků na prázdno, a to 5 min při 5 V/cm.
• Poté naneste vzorky a nechte elektroforézu běžet. V průběhu elektroforézy několikrát (např. každou hodinu) promíchejte elekroforetický pufr ve vaně, eventuálně pro promíchávání pufru použijte elekroforetickou vanu s peristaltickou pumpou.
• Po ukončení elektroforézy promývejte gel nejprve ve vodě po dobu 15 min, poté 2 x 15 min v 10x SSC.
• Proveďte transfer na membránu a imobilizaci RNA na membráně podobným způsobem jako u Southernova blotu.
——————————————————————————————————————————–——————————————————————————————————————————–
PREHYBRIDIZACE A HYBRIDIZACE
• Inkubujte membránu 2 hod při 68oC v 10-20 ml prehybridizačního roztoku.
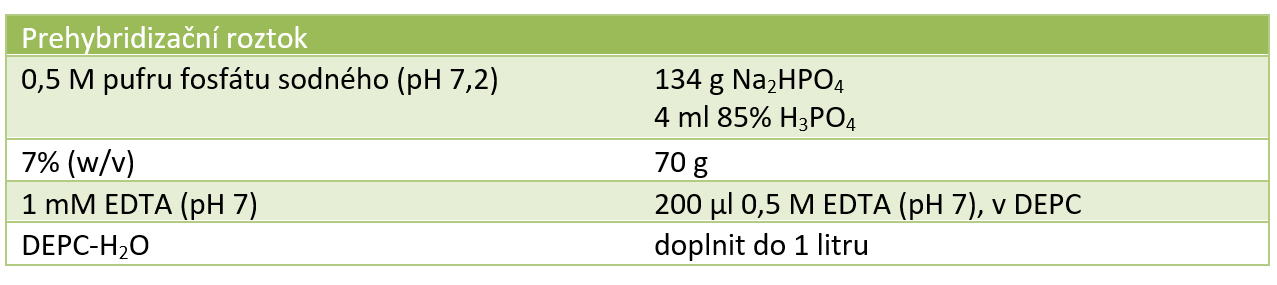
Příprava 0,5 M pufru fosfátu sodného: 134 g Na2HPO4. 7 H2O rozmícháme v DEPC-dH2O. Objem vody by měl být takový, aby po přidání dalších komponent vznikl roztok o 1l. Přidáme 4 ml 85% H3PO4.
• Inkubujte membránu v hybridizačním roztoku s přidanou sondou. Pokud je sonda dvouřetězcová je třeba ji ale předem denaturovat, a to zahřátím na 100 oC po dobu 5 min a následným rychlým zchlazením uložením na led, minimálně na 3 min a poté ji můžeme přidat do hybridizačního roztoku.
• Hybridizaci provádějte 12-16 hod při teplotě:
u většiny dlouhých sond (>100 bazí) 65-68 oC
u krátkých/oligo sond (< 50 b) je hybridizační teplota o 5 oC nižší než je teplota Tm. Teplota Tm = 4x počet GC párů + 2x počet AT párů
• Pro detekování malého množství mRNA, použijte alespoň 0,1 μg radioaktivně značené sondy, jejíž aktivita přesahuje 2×108 cpm/μg.
• Pro detekování sondy, která není plně homologní s cílovým úsekem, používáme nízko-stringentní podmínky, tj. hybridizace je prováděna při 37-42 oC v hybridizačním pufru obsahujícím 50% deionizovaný formamid, 0.25 M fosfát sodný (pH 7.2), 0.25 M NaCl, a 7% SDS.
——————————————————————————————————————————–——————————————————————————————————————————–
POSTHYBRIDIZAČNÍ PROMÝVÁNÍ MEMBRÁNY
Po ukončení hybridizace membránu promývejte v:
• 100-200 ml 1x SSC, 0.1% SDS při pokojové teplotě, 10 min,
• 100-200 ml roztoku 0.5x SSC, 0.1% SDS, předehřátého na 68oC. Promývejte při 68oC po dobu 10 min. Tento promývací krok opakujte 2x.
——————————————————————————————————————————–——————————————————————————————————————————–
DETEKCE: Detekujte sondu autoradiograficky.
——————————————————————————————————————————–——————————————————————————————————————————–
ODSTRANĚNÍ SONDY Z MEMBRÁNY PRO OPĚTOVNÉ POUŽITÍ MEMBRÁNY
Pro odstranění navázané sondy z membrány pro opětovné použití membrány lze využít inkubaci membrány po 1-2 hod ve velkém objemu buď roztoku 10 mM Tris-Cl (pH 7.4) 0.2% SDS, předehřátého na 70-75 ºC nebo roztoku 50% deionizovaného formamidu, 0.1x SSC, 0.1% SDS předehřátého na 68 ºC.
