Southernova hybridizace (či také Southernův blot) je metoda využívaná k detekci molekuly DNA, obvykle ke zjištění její přítomnosti, velikosti či množství.
Základním principem je hybridizace DNA, tj. vzájemné párování jednořetězcových molekul DNA, ke kterému dochází na základě komplementarity mezi bázemi hybridizovaných molekul (více info zde: Hybridizační metody – LabGuide.cz (posunemevasvys.cz).
Při této metodě je testovaná molekula DNA chemicky či teplem denaturována (z dvouřetězcové molekuly vznikají dvě jednořetězcové) a v této denaturované formě je nanesena na membránu. Vzorek nukleové kyseliny imobilizovaný na membráně je následně hybridizován se značenou sondou, která umožní vizualizaci hledané molekuly.
Celý proces Southernovy hybridizace se sestává z těchto kroků:
ELFO: Vzorky DNA jsou elektroforeticky separovány v agarosovém gelu.
Denaturace: Po elektroforetické separaci jsou vzorky DNA přímo v agarosovém gelu denaturovány, a to ponořením gelu do silně alkalického roztoku. Dvouřetězcové molekuly jsou tím separovány na jednořetězce.
Přenos: Vzorky denaturované DNA jsou přeneseny na membránu, a to tzv. blotovací technikou.
• Používají se membrány nylonové, nitrocelulosové nebo PVDF membrány; u každého z těchto typu membrán jsou dostupné ještě další typy s různými specifikami. Volba druhu membrány se odvíjí od způsobu detekce sondy, tj. obvykle dle doporučení výrobcem daného systému. V současné době se nejčastěji používají pozitivně nabité nylonové membrány.
• Přenos na membránu je buď kapilárním způsobem, pomocí vakua a nebo se provádí tzv. elektropřenos. Všechny tři uvedené způsoby poskytují kvalitní výsledky, ale samozřejmě je třeba brát v úvahu, že čím je přenos rychlejší, tím budou přenesené proužky nukleové kyseliny ostřejší. Výsledkem je membrána s navázanou nukleovou kyselinou, a to v pozicích, které věrně odrážejí jejich původní pozice na gelu po elektroforetické separaci.
• Nukleová kyselina je na membráně navázaná na základě iontové vazby mezi nukleovou kyselinou a membránou. Vzhledem k tomu, že působením některých chemikálií, které jsou použity pro následnou hybridizaci by docházelo k rozrušování iontových vazeb a značné ztrátě navázané nukleové kyseliny, je třeba nukleovou kyselinu na membráně ireverzibilně imobilizovat. Tato ireverzibilní imobilizace se děje pomocí vytvoření kovalentních vazeb s využitím UV záření (pomocí tzv. UV crosslinku) či tepla.
Hybridizace: Membrána se vzorky DNA je inkubována v hybridizačním roztoku se značenou sondou.
• Sonda je fragment DNA komplementární k cílovému úseku nukleové kyseliny na membráně.
• Minimální délka sondy musí být alespoň 18 bazí pro zajištění určité specificity při hybridizaci, a to zvlášť pokud pracujeme s genomovou DNA či RNA.
• Sonda může být vyrobena nejrůznějším způsobem, např. může to být PCR produkt, zaklonovaný fragment, oligonukleotid vyrobený komerčně.
• Sonda může být jednořetězcová nebo dvouřetězcová. V případě dvouřetězcové sondy, musí být sonda předem denaturovaná.
• Sondou může být molekula DNA nebo RNA.
• Sondy jsou značeny radioaktivně (nejčastěji pomocí 32P) nebo neradioaktivně (nejčastěji digoxigeninem).
Sonda se k membráně přidává v hybridizačním roztoku. Hybridizační roztok v různých obměnách obsahuje:
• pufr (nejčastěji 5X SSC – Saline Sodium Citrate, roztok citronanu sodného a chloridu sodného), detergent (nejčastěji SDS nebo N-laurosylsarcosin),
• dextran sulfát jako vytěsňovací médium (vytěsňuje vodu z roztoku a tím se sonda dostává blíže k membráně),
• blokovací látky (BSA, kasein, DNA lososích spermií), které vyváží místa pro nespecifické nasedání sondy na membránu, a tím snižuji po hybridizaci nežádoucí pozadí,
• formamid, který snižuje teplotu tání a zvyšuje tak specificitu hybridizace.
Posthybridizační promytí membrány: Z membrány se odmývá nespecificky navázaná sonda (molekuly sondy navázány jinde než k cílové molekule). Jako promývací roztok je využíván roztok SSC s SDS, temperovaný na vyšší teplotu. Teplota a koncentrace solí udávají stringencitu (tj. účinnost) promývání.
• Se zvyšující se teplotou a snižující se koncentrací solí jsou podmínky promývání stringentnější, tj. účinnější a naopak.
• Pokud zvyšujeme stringencitu, zvyšujeme pravděpodobnost rozpadu nespecificky zformovaných hybridních molekul (sondy-cílové molekuly).
• Stringencitou při promývání ovlivňujeme míru jak odmytí nespecifického pozadí, tak ale i intenzitu specifického signálu.
• Nižší stringencitu promývání zvolíme, pokud pracujeme se sondou, která je k cílové DNA specifická jen částečně.
• Vyšší stringencitu promývání zvolíme, pokud pracujeme se sondou, která je k cílové DNA 100% specifická.
Vizualizace sondy: Poté, co se sonda navázala k DNA na membráně, je poloha sondy vizualizována. Způsob vizualizace se odvíjí od způsobu značení sondy.
—————————————————————————————————————————————————————————————————————————————————————————-
DENATURACE DNA V GELU
Nejprve je DNA separovaná standardně použitím agarosové elektroforézy (obvykle v 0,5-1 % gelu).
Poté následují kroky vedoucí k denaturaci DNA:
• Depurinace DNA pro fragmentaci příliš dlouhých fragmentů: gel je ponořen do depurinačního roztoku (0.25 M HCl) na 10 min. Pokud je v nanášecím roztoku při ELFO použita bromfenolová modř, při depurinačním kroku by se měla modrá barva bromfenolové modře změnit na žluto-zelenou. Krok depurinace umožní fragmentaci dlouhých úseků DNA na menší a usnadní tak lepší přenos fragmentů na membránu. Gel je poté opláchnut v destilované vodě.
• Denaturace: Gel je ponořen do denaturačního roztoku (0.5 M NaOH, 1.5 M NaCl) na 2 x 15 min, poté je gel opláchnut v destilované vodě.
• Neutralizace: gel je ponořen do neutralizačního roztoku (0.5 M Tris-HCl, 3 M NaCl, pH 7.5) na 2 x 15 min.
—————————————————————————————————————————————————————————————————————————————————————————-
PŘENOS DNA Z GELU NA MEMBRÁNU
•Připravíme si přenosový můstek. Jako můstek nám může posloužit elektroforetická vanička otočená dnem vzhůru nebo krabička od špiček otočená dnem vzhůru. Můstek položíme na dno vaničky. Velikost vaničky, tj. její plocha, by měla být alespoň o 1/3 větší než je plocha gelu.
• Na můstek položíme předvlhčený (20X SSC) filtrační papír, tak aby jeho okraje dosahovaly na dno vaničky.
![]() Dbáme, aby pod filtračním papírem nebyly bubliny. Pokud tam bubliny jsou, vytlačíme je např. za pomoci skleněné tyčinky.
Dbáme, aby pod filtračním papírem nebyly bubliny. Pokud tam bubliny jsou, vytlačíme je např. za pomoci skleněné tyčinky.
• Na můstek s filtračním papírem položíme gel, a to jeho spodní stranou nahoru (jamky dnem nahoru). Opět odstraníme veškeré bubliny, které se pod gelem případně vytvořily. Povrch gelu lehce zalijeme 20x SSC.
• Na gel položíme nylonovou membránu předvlhčenou vodou tak, aby se ustřižený roh membrány překrýval s uříznutým rohem gelu. Opět odstraníme bubliny.
![]() S membránou manipulujeme zásadně v rukavicích. Nejlépe membránu držíme za její okraje pinzetou.
S membránou manipulujeme zásadně v rukavicích. Nejlépe membránu držíme za její okraje pinzetou.
• Na membránu položíme dva kusy filtračního papíru o stejném rozměru jako má gel. Filtrační papír předem předvlhčíme v 20x SSC. Odstraníme veškeré bubliny.
• Poté položíme absorbentní vrstvu, např. 6-10 cm vrstvu buničiny o rozměrech gelu.
• Absorbentní vrstvu shora zatížíme deskou (libovolného materiálu) a závažím o cca 0,5 kg (může posloužit 0,5 l lahev se šroubovacím víčkem, která je naplněná 0,5 l vody.
• Do spodní misky nalijeme 20x SSC tak, aby hladina byla pod horním okrajem stojánku. Necháme vzlínat 6-12 hodin.
• Proti případnému vzlínání pufru okolo gelu izolujeme pomocí pásků alobalu vrchní stranu přesahů filtračního papíru, který leží na můstku.
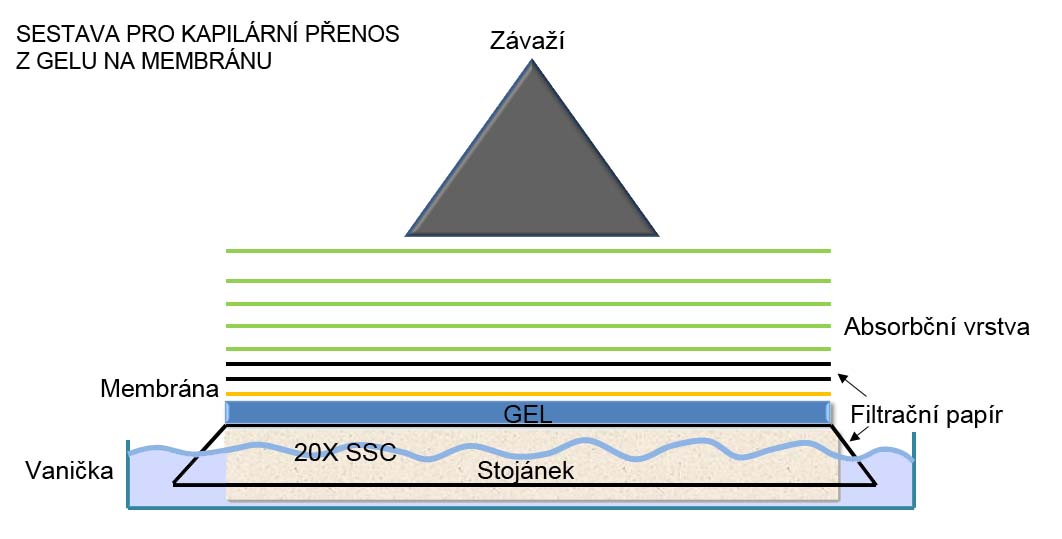
—————————————————————————————————————————————————————————————————————————————————————————-
PROMYTÍ MEMBRÁNY A IREVERZIBILNÍ IMOBILIZACE DNA NA MEMBRÁNĚ
• Rozebereme přenosovou sestavu.
• Překlopíme membránu s gelem na suchý filtrační papír (gelem nahoru). Abychom získali orientaci o horní/spodní straně membrány a poloze vzorků, měkkou tužkou propíšeme jamky v gelu na membránu.
• Membránu proplachujeme 5 min v 6x SSC.
• Membránu položíme na suchý filtrační papír, necháme osušit a vzorky na membráně fixujeme pomocí UV buď přímo v UV crosslinkeru nebo 3 min na transiluminátoru, alternativně 30-60 min při 120°C.
• Membrána je v tomto kroku připravena pro hybridizaci, alternativně může být zabalena do plastové fólie a uchována ve 4°C pro pozdější použití.
—————————————————————————————————————————————————————————————————————————————————————————-
HYBRIDIZACE
• Suchou nylonovou membránu navlhčíme ponořením do vody. Přeneseme membránu do 0,1X SSC/0,5% SDS. Inkubujeme při 65°C, 1 hod.
• Membránu vložíme do prehybridizačního roztoku předehřátého na 65°C. Na každý 1 cm2 membrány použijeme alespoň 100 ul prehybridizačního roztoku. Inkubujeme za stálého promícháváním při 65 °C, 2 hodiny.
![]() Prehybridizace a hybridizace mohou být prováděny v hybridizačních válcích nebo vhodných plastových nádobách, případně také v igelitových pytlících, jejichž okraje jsou utěsněny zavařením nebo zalepením (využití igelitových pytlíků je výhodné, pokud prehybridizujeme/hybridizujeme v malých objemech roztoků).
Prehybridizace a hybridizace mohou být prováděny v hybridizačních válcích nebo vhodných plastových nádobách, případně také v igelitových pytlících, jejichž okraje jsou utěsněny zavařením nebo zalepením (využití igelitových pytlíků je výhodné, pokud prehybridizujeme/hybridizujeme v malých objemech roztoků).
Prehybridizační roztok*

* skladováno v alikvotech v -20 °C, před použitím přidejte denaturovanou DNA lososích spermií a temperujte na 65 °C.
** do roztoku se přidává až před použitím. Před přidáním se DNA lososích spermií denaturuje zahřátím na 95 °C 5 min a poté prudkým zchlazením uložením na led na minimálně 1 min.
- Prehybridizační roztok vyměníme za hybridizační roztok, který jsme předem vytemperovali na 65 °C a přidali jsme denaturovanou sondu. Množství přidávané sondy se odvíjí od způsobu značení. Pokud je sonda značená 32P, obvykle přidáváme tolik sondy, aby výsledná koncentrace byla 2 x 106 cpm/ml (může být v rozmezí od 0,5 x 106 až 3 x 106 cpm/ml). Pokud je sonda značena neradioaktivně, řídíme se doporučením výrobce značícího systému.
- Hybridizaci provádějte 12 – 16 hod při teplotě:
– u většiny dlouhých sond (>100 bazí) 65 – 68 oC
– u krátkých/oligo sond (< 50 b) je hybridizační teplota o 5 oC nižší než je teplota tání (Tm). Přičemž Tm = 4x počet GC párů + 2x počet AT párů
Hybridizační roztok*

* skladováno v alikvotech v -20 °C, před použitím přidejte denaturovanou DNA lososích spermií a temperujte na 65 °C.
** do roztoku se přidává až před použitím. Před přidáním se DNA lososích spermií denaturuje zahřátím na 95 °C 5 min a poté prudkým zchlazením uložením na led na minimálně 1 min.
—————————————————————————————————————————————————————————————————————————————————————————-
POSTHYBRIDIZAČNÍ PROMÝVÁNÍ
Membrána je promývána nízko-stringentními podmínkami, pokud očekáváme, že sonda není úplně identická s cílovou sekvencí. V opačném případě používáme vysoce-stringentní podmínky.
• Při vysoce-stringentních podmínkách:
Promyjeme membránu v promývacím roztoku I (2X SSC/0,1% SDS), při pokojové teplotě 5 min, za konstantního promíchávání.
Promývací roztok I nahradíme promývacím roztokem II (0,1x SSC/0,1% SDS). Promýváme při 65°C, 10 min. Tento promývací krok 1-2x opakujeme.
• Při nízko-stringentních podmínkách:
Pro promývání s nízko-stringentními podmínkami se využívá pouze 2x SSC/0,1% SDS, teplota je určena empiricky, kdy jako nejnižší je použita 37°C.
—————————————————————————————————————————————————————————————————————————————————————————-
DETEKCE SONDY
Způsob detekce sondy se provádí v závislosti na typu značení sondy, a to buď autoradiograficky v případě radioaktivně značené sondy, nebo jiným systémem dle způsobu značení sondy.
—————————————————————————————————————————————————————————————————————————————————————————-
ODSTRANĚNÍ SONDY Z MEMBRÁNY
Odstranění sondy z membrány se provádí pro opětovné použití membrány pro hybridizaci. Nylonové membrány mohou být použity 10 – 30x. Suchá membrána může být uskladněna při pokojové teplotě.
Postupujte takto:
- Vložte membránu do roztoku 0,2 M NaOH a za konstantního promíchávání inkubujte 10 min. Použijte cca 1 – 2 ml NaOH na každý 1 cm2. Odstraňte NaOH.
- Promyjte membránu 3x v 0,1 SSC/0,1% SDS/50 mM Tris-HCl (pH 7,5) po 5 min. Použijte cca 1 – 2 ml roztoku na každý 1 cm2. Monitorujte pH promývacího roztoku pomocí pH papírku. Pokud roztok není neutrální, opakujte promývací kroky.
—————————————————————————————————————————————————————————————————————————————————————————-
ALTERNATIVNÍ PREHYBRIDIZAČNÍ A HYBRIDIAČNÍ ROZTOKY
Alternativně mohou být pro prehybridizaci a hybridizaci použity roztoky s přídavkem formamidu, který snižuje teplotu tání DNA. Tímto může být hybridizace prováděna při 42 °C.
Prehybridizační roztok s formamidem*

* skladováno ve 4 °C, délka skladovatelnosti max. 4 měsíce, před použitím přidejte denaturovanou DNA lososích spermií a temperujte na 65 °C.
** do roztoku se přidává až před použitím. Před přidáním se DNA lososích spermií denaturuje zahřátím na 95 °C 5 min a poté prudkým zchlazením uložením na led na minimálně 1 min.
Hybridizační roztok s formamidem*

* skladováno ve 4 °C, délka skladovatelnosti max. 4 měsíce, před použitím přidejte denaturovanou DNA lososích spermií a temperujte na 65 °C.
** do roztoku se přidává až před použitím. Před přidáním se DNA lososích spermií denaturuje zahřátím na 95 °C 5 min a poté prudkým zchlazením uložením na led na minimálně 1 min.
Příprava 1 M fosfátu sodného (pH 6,7)
Rozpustíme 14,196 g Na2HPO4 v 80 ml vody. Upravíme pH na 6,7 pomocí kyseliny fosforečné a doplníme do 100 ml.
