KVANTITATIVNÍ REAL-TIME PCR
Metoda real-time PCR slouží pro kvantifikaci DNA a transkripce.
• Metoda je založena na klasické PCR, ovšem s využitím speciálního cycleru, který v průběhu PCR kontinuálně zaznamenává množství DNA, a to v průběhu každého cyklu.
• Detekce množství DNA je umožněna přítomností fluorescenčního substrátu, který se váže na přítomnou DNA. Fluorescence je vyzařovaná substrátem až po jeho navázání na DNA, tedy nikoliv volným substrátem.
• Hladina fluorescence substrátu navázaného na DNA je detekovaná detektorem a odráží množství přítomné DNA, tj. i množství výchozího templátu.
• Real-time PCR se obvykle provádí v 96-ti jamkových destičkách. Úroveň fluorescence je zaznamenávaná v jednotlivých jamkách.
• Pro detekci cílové DNA je real-time PCR je vysoce citlivou metodou a pokud jsou využity specifické fluorescenční substráty, tak je to i metoda vysoce specifická.
—————————————————————————————————————————-—————————————————————————————————————————-——————
ZDROJ FLUORESCENCE
Pro zdroj fluorescence se využívá několik technologií:
• FRET
Sybergreen na rozdíl od ostatních způsobů je fluorescenčním substrátem, který je vzhledem k vazbě na DNA nespecifický (váže se kdekoliv). Přesnost výsledků s použitím SyberGreenu může být v některých případech nižší než při použití ostatních uvedených postupů. Nicméně vzhledem k jeho versatilnosti (využití pro jakýkoliv DNA templát) a relativně nízkou cenu, je nejpoužívanějším způsobem kvantifikace při real-time PCR.
—————————————————————————————————————————-—————————————————————————————————————————-——————
RELATIVNÍ X ABSOLUTNÍ KVATIFIKACE
Kvantifikace je prováděna buď jako relativní (častěji), kdy se množství fluorescence testovaného vzorku porovnává s množstvím fluorescence jiného vzorku, nebo absolutní, kdy množství DNA odečítáme z kalibrační křivky, které nám poskytne vzorek DNA o dané koncentraci.
—————————————————————————————————————————-—————————————————————————————————————————-——————
KINETIKA PCR REAKCE
Průběh PCR reakce lze rozdělit do čtyř fází:
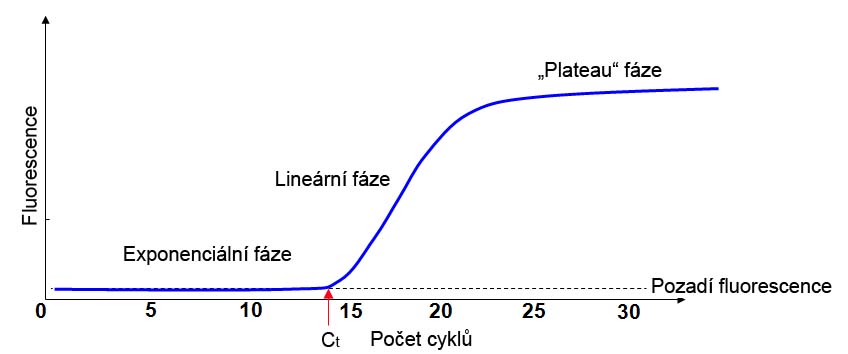
1.fáze: v této fázi lze očekávat exponenciální nárůst množství DNA. Množství DNA a tím i fluorescence je nízký a nepřesahuje úroveň pozadí.
2. fáze: průběh reakce je v této fázi exponenciální, syntéza DNA je již na takové úrovni, že intenzita fluorescence přesahuje úroveň pozadí a může být zachycena detektorem. V ideálním případě nárůst množství DNA je dle 2n, kde n je pořadí cyklu. Intenzita fluorescence a množství DNA věrně odráží množství templátové DNA dodané do reakce, a proto se kvantifikace templátové DNA provádí na základě fluorescence detekované v této fázi.
3. fáze: jedná se o lineární fázi (2n+1, kde n je pořadí cyklu). Množství templátové DNA je na takové úrovni, že v této fázi dochází k strmému nárůstu fluorescence.
4. fáze: tzv. „plateau“ fáze, je fáze, kdy je sice přítomno obrovské množství templátové DNA, ale dochází k únavě reakce (např. některé komponenty reakce byly již spotřebovány) a tak se kinetika reakce výrazně zpomaluje. Např. při standardní PCR finální produkt odpovídá plateau fázi. Množství fluorescence produkované v této fázi nemusí vůbec reflektovat množství templátové DNA dodané do reakce a tak není vhodné tuto fázi pro kvantifikaci DNA využívat.
—————————————————————————————————————————-—————————————————————————————————————————-——————
KONCEPT Ct HODNOTY
Real-time PCR je založena na konceptu Ct hodnoty (Ct jako cycle of treshold, cyklus prahu). Ct hodnota reflektuje cyklus, kdy dochází k nárůstu fluorescence nad práh pozadí, které se v reakci vyskytuje. Tato fluorescence je zachycena detektorem. Číslo tohoto cyklu je zaznamenáno a dále využíváno právě jako Ct hodnota. Přitom je důležité si uvědomovat, že čím je Ct nižší, tím více bylo do reakce dodáno templátové DNA, a naopak.
Pokud budeme uvažovat, že účinnost PCR reakce je ideálních 100%, lze rozdíl v koncentraci templátové DNA nanesené do reakce u srovnávaných vzorků, vyhodnotit jako rozdíl v Ct hodnotách. Tj. jako 2 ∆Ct, kde ∆Ct je rozdíl v Ct hodnotách mezi srovnávanými vzorky.
—————————————————————————————————————————-—————————————————————————————————————————-——————
REFERENČNÍ GEN JAKO VNITŘNÍ KONTROLA
Při kvantifikaci je obvykle nezbytné vyhodnotit také vnitřní („nanášecí“) kontrolu, která nám určí, do jaké míry bylo u testovaných vzorků použito srovnatelné množství vstupního materiálu. Jako vnitřní kontrola jsou vyhodnocovány geny, jejichž transkripce či počet jejich kopií v genomu či testované DNA by měly být stejné u všech testovaných vzorků. Tj. jestli rozdíl, který jsme zjistili u cílového genu, skutečně odpovídá rozdílu v cílovém genu a ne díky tom, že DNA testovaných vzorků byla do reakcí nanesena v nestejné koncentraci. Používají se tzv. referenční geny, tj. nejčastěji „housekeeping“ geny, jako geny aktinu, tubulinu, geny pro ribosomální proteiny.
Kalkulace s použitím interní kontroly potom tedy je 2 ∆Ct1 – ∆Ct2, kde ∆Ct1= Ct (target 1)– Ct(ref 1), ∆Ct2= Ct (target 2)– Ct(ref 2). Kde target 1 je cílový gen u vzorku 1, target 2 cílový gen u vzorku 2, ref 1 je referenční kontrola vzorku 1 a ref 2 je referenční kontrola vzorku 2.
—————————————————————————————————————————-—————————————————————————————————————————-——————
ZOHLEDNĚNÍ ÚČINNOSTI (EFEKTIVITY) PCR
• Pro přesnější kvantifikaci při real-time PCR je třeba při výpočtu zohlednit účinnost vlastní reakce. PCR reakce probíhá se 100% účinností (efektivitou) pouze v ideálních případech, ve skutečnosti je účinnost reakce více či méně snížená.
• Účinnost PCR reakce je daná účinností přisedání primerů, složením reakce, přítomností PCR inhibitorů nebo naopak enhancerů.
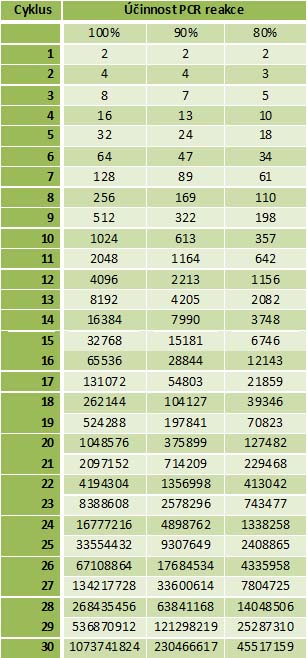
• Pokud je efektivita reakce 100%, platí, že v každém cyklu dojde ke zdvojnásobení množství molekul DNA, tzn. reakce běží dle 2n, kde n je počet proběhlých cyklů. Pokud je efektivita snížena, reakce je dle effn, kde eff je efektivita a n je počet proběhlých cyklů. Např. pokud je efektivita 100%, množství molekul DNA vzniklých z jediné molekuly po deseti cyklech je 210, tj. 1024 molekul. Pokud je efektivita 90%, množství molekul DNA vzniklých z jediné molekuly po deseti cyklech je 1,910, tj. jen 613. Z toho je patrné, že účinnost reakce je důležitým faktorem pří kvantifikaci.
• Účinnost reakce lze kalkulovat ze sklonu standardní křivky. Standardní křivka je vyjádřením vztahu Ct hodnoty vzhledem ke vstupní DNA.
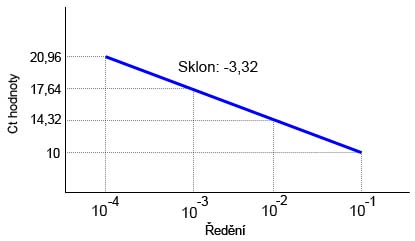
• Standardní křivku získáme tak, že připravíme ředící řadu templátové DNA (např. desítkovým ředěním). S jednotlivými vzorky ředící řady provedeme real-time PCR a pro každé ředění získáme Ct hodnotu. Ze získaných hodnot připravíme standardní křivku, a to tak, že v grafu propojíme Ct hodnoty s hodnotami daných ředění. Pomocí hodnoty sklonu křivky vypočteme účinnost reakce, a to dle
E= (10(-1/Slope) -1 )x 100. Není třeba standardní křivku připravovat “ručně”, stejně tak jako počítat účinnost, software dodaný s real-time PCR cyclerem tento výpočet umožňuje.
Sklon standardní křivky je, pokud je efektivita reakce 100%, -3,32. Pokud je hodnota sklonu nižší (např. -3,8), znamená to, že reakce probíhala s efektivitou menší než 100%. Pokud je naopak hodnota sklonu vyšší (např. -3,2), indikuje to nízkou kvalitu vzorku či problémy při přípravě reakce. PCR reakce se 100% efektivitou produkuje během exponenciální fáze 10-ti násobný nárůst PCR produktu každých 3,32 cyklu (log210= 3,32).
• Účinnost reakce by měla být co nejvyšší, tj. velmi blízká 100% nebo alespoň > 100%. Pokud je účinnost výrazně nižší, snižuje se přesnost kvantifikace.
• Získanou hodnotu účinnosti PCR zahrneme při kvantifikaci srovnávaných vzorků. Pro výpočet využijeme tento vzorec R = Eff.(ref.) Ct(ref.) / Eff.(target) Ct(target), kde target je cílový gen, ref. je gen vnitřní kontroly, Eff. je efektivita reakce k cílovému genu nebo reakce ke genu vnitřní kontroly.
Obvykle je dostačující vyhodnotit efektivitu v prvotním experimentu a v následujících experimentech již jen získané údaje o efektivitě stačí zahrnout. V některých případech je ale nutné vyhodnocovat efektivitu paralelně s testovanými vzorky v rámci jednoho experimentu.
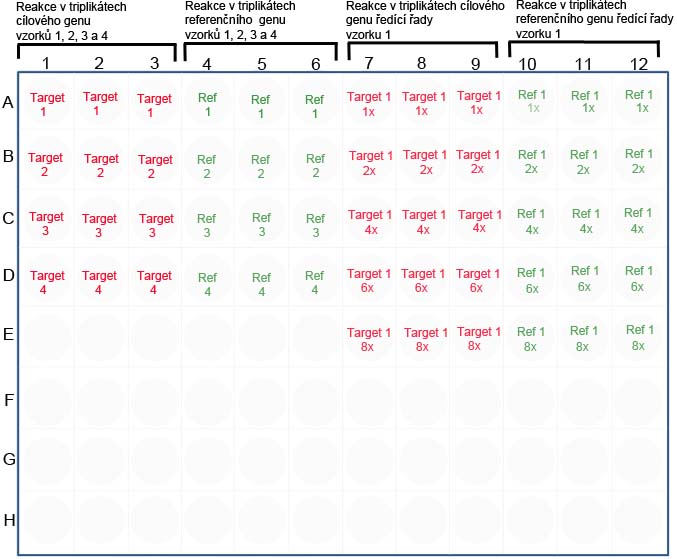
Příklad:
Např. použitím relativní kvantifikace srovnáváme expresi genu pro protein A mezi vzorky 1 a 2. Jako vnitřní kontrolu použijeme primery pro gen pro aktin. Připravíme si vzorky standardní křivky, a to tak, že jeden z testovaných vzorků naředíme tak, abychom získali ředící řadu. S každým vzorkem ředící řady provedeme reakci (nejlépe v triplikátech), a to jak s primery pro gen A, tak s primery pro aktin. Ze získaných Ct hodnot v triplikátech vypočteme průměrnou ct hodnotu, a tu použijeme pro výpočet efektivity. Paralelně provedeme reakci (opět nejlépe v triplikátech) s oběma testovanými vzorky, tj. 1 a 2 a pro oba vzorky tak získáme Ct hodnoty, a to jak pro gen A, tak gen aktinu. Z triplikátů vypočteme průměrné Ct hodnoty. Všechny získané hodnoty využijeme pro výpočet.

Efektivita reakce u genu A je 1,95.
Efektivita reakce u genu aktinu je 1,9.
Výpočet je následovný:
R1= 1,89 23,2/1,95 25,5= 0,104
R2= 1,89 24,1/1,95 22,1=1,79
Z těchto výsledků můžeme konstatovat, že exprese genu A je u vzorku 2 17x vyšší než u vzorku 1.
Pro daný výpočet můžete využít naší kalkulačku.
—————————————————————————————————————————-—————————————————————————————————————————-——————
KŘIVKA TÁNÍ A NESPECIFICKÉ PRODUKTY

• Pokud pro real-time PCR využíváme SyberGreen, můžeme velmi snadno kontrolovat, jestli v průběhu reakce vznikají nespecifické produkty či primery-dimery. Je k tomu využívána křivka tání, tzv. melting curve, která využívá toho, že různé PCR produkty mají různé teploty tání.
• Nespecifické produkty mají obvykle teplotu tání nižší než specifické. Křivka tání ukazuje změnu intenzity fluorescence při různých teplotách. Pokud má křivka tání pouze jeden vrchol, reakce je čistě specifická, pokud křivka má dva a více vrcholů, znamená to, že kromě specifických produktů vznikají také nespecifické.
• Křivku tání lze po proběhnutí reakce zobrazit dodaným softwarem k real-time cycleru.
—————————————————————————————————————————-—————————————————————————————————————————-——————
FAKTORY OVLIVŇUJÍCÍ PŘESNOST REAL-TIME PCR
Přesnost kvantifikace pomocí real-time PCR může ovlivňovat řada faktorů, které mohou být součástí přípravy PCR reakce, přípravy vzorků či samotné sekvence primerů.
• Pro zajištění co největší přesnosti při kvantifikaci, musíme v první řadě jednotlivé vzorky simultánně kvantifikovat v několika opakováních (nejčastěji v triplikátech). Ct hodnoty jednotlivých opakování nám poskytnou představu o tom, do jaké míry je reakce přesná. Je žádoucí, aby rozptyl byl co nejmenší, běžně se uvádí < 0,3 cyklu, ale konkrétní požadavky se mohou lišit v závislosti na daném experimentu. Např. si můžeme snadno odvodit, že rozdíl jednoho cyklu se při 100% účinnosti rovná dvounásobnému rozdílu v množství DNA. Na základě našich požadavků a toho, jak velké rozdíly mezi vzorky očekáváme, si můžeme stanovit, jak velký rozptyl v daných triplikátech je pro nás přijatelný a jaký již ne.
• Pokud ct hodnoty jednotlivých opakování jsou vyšší než 0,3 cyklu, obvykle to značí metodický problém:
Nepřesnosti v přípravě PCR reakce: nepřesné pipetování, špatné promíchání či přítomnost kontaminace.
Nepřesnosti dané přípravou standardů standardní křivky: Špatné pipetování standardů, tj. neúměrně vyšší či nižší množství vzorku k přidané vodě, a to konzistentně v celé ředící řadě. Hodnota sklonu křivky je poté nižší či naopak vyšší, značící vyšší či nižší PCR efektivitu.
Nepřesnosti dané přípravou vzorku, tj. nízká kvalita vzorku: Kvalitu vzorku pro real-time PCR snižuje přítomnost:
-
- PCR inhibitorů, jako jsou pozůstatky fenolu, reakční zbytky po cDNA syntéze, proteiny či další příměsi,
- cDNA připravená ze vzorku degradované RNA či vzorku, u nějž byla koncentrace RNA kvantifikována nepřesně,
- kontaminace genomovou DNA ve vzorku RNA,
- nízká koncentrace vstupní DNA.
Nízká efektivita PCR reakce: může být daná nevhodně zvolenou sekvencí primerů, nevhodnou přípravou PCR reakce a nízkou kvalitou testovaných vzorků
—————————————————————————————————————————-—————————————————————————————————————————-——————
PŘÍPRAVA REAKCE
Primery a délka produktu
S výjimkou Scorpion sond, jsou primery pro real-time PCR navrhovány standardním způsobem. Je třeba dbát zvýšené pozornosti ohledně nespecifického vázání primerů. Primery musí být specifické! Funkčnost primerů je třeba nejprve ověřit standardní PCR a elektroforetickou separací v agarosovém gelu. Je doporučováno vyhodnotit účinnost reakce s danými primery a tu pak zohlednit při konečném výpočtu. Optimální délka produktu se pohybuje kolem 100 bp, může být vyšší, avšak neměla by přesáhnout 500 bp.
Příprava vzorků
• Jako vzorky pro reakci se používají vzorky DNA či cDNA.
• Průběh reakce může být snadno ovlivněn kontaminanty přítomnými ve vzorcích. Týká se to především vzorků cDNA, které nebyly přečištěny od reakčních komponent po syntéze cDNA a které mohou PCR reakci znehodnocovat. Z toho důvodu musí být vzorky od všech možných příměsí přečištěny (např. s využitím purifikačních kolonek) nebo jednoduše musí být dostatečně naředěny vodou. Naředěním vzorků klesne koncentrace přítomných příměsí na dostatečné minimum, avšak koncentrace DNA je stále dostatečná na to, aby sloužila jako templát reakce. Míru ředění je třeba stanovit empiricky, nicméně ve většině případů se používá ředění 5-10x. Všechny testované vzorky naředíme stejným způsobem a důkladně promícháme.
• Protože real-time PCR je značně náchylná na nepřesnosti v průběhu přípravy reakce, jako především na chyby při pipetování, vzorky přidáváme do reakce pokud možno raději ve větším objemu, např. 5 μl.
Příprava reakce
• Při přípravě reakci používáme pipetovací špičky s filtrem.
• Reakce připravujeme v Master mixu, přičemž počítáme s tím, že reakce je u každého vzorku prováděna v triplikátech, tzn. reakci připravujeme v 3x větším objemu. Počítáme s 1-2 reakcemi navíc jako rezervu.
• Pokud je třeba připravíme si reakce i pro standardní křivku.
• Reakci připravíme smícháním vody, SyberGreenu a páru primerů a dbáme pokynů v návodu dodaného výrobcem k používanému SyberGreenu.
• Zahrneme i kontrolní vzorky, a to především negativní kontrolu na kontaminaci při přípravě reakce tak RT- kontrolu.
• Připravené Master mixy důkladně promícháme (pozor – někteří výrobci nedoporučují intenzivní vortexování).
Nanášení reakcí na PCR destičku
• Připravíme si pipetovací schéma, podle kterého budeme reakce nanášet do jednotlivých jamek destičky. Pipetovací schéma ke stažení najdete zde.
• Připravenou reakci pipetujeme do jamek PCR destičky, a to obvykle v objemu 25 μl (obvykle dostatečné) nebo 50 μl.
• K reakcím přidáme testované vzorky.
• Při pipetování dbáme na přesnost!
• Destičku seshora přikryjeme fólií, přičemž se snažíme destičku fólií co nejlépe utěsnit, tak aby se minimalizovalo odpařování.
Reakce
Destičku vložíme do cycleru a nastavíme reakční profil. Zvolíme požadovanou teplotu přisedání primerů a dobu extense, další parametry reakce nastavíme dle manuálu dodaného výrobcem k cycleru či SyberGreenu.
Vyhodnocení experimentu
• Po ukončení reakce zkontrolujeme správnost průběhu reakcí dle amplifikační křivky a křivky tání.
• Zkontrolujeme rozptyl jednotlivých Ct hodnot v každém triplikátu. Je žádoucí, aby rozptyl byl co nejmenší, běžně se uvádí < 0,3 cyklu, ale konkrétní požadavky se mohou lišit v závislosti na daném experimentu. Např. si můžeme snadno odvodit, že rozdíl jednoho cyklu se při 100% účinnosti rovná dvounásobnému rozdílu v množství DNA. Na základě našich požadavků a toho, jak velké rozdíly mezi vzorky očekáváme, si můžeme stanovit, jak velký rozptyl v daných triplikátech je pro nás přijatelný a jaký již ne.
• Optimálně by se Ct hodnoty měly pohybovat mezi 20-25, pokud jsou Ct hodnoty výrazně vyšší, např. > 35, zvyšuje se riziko nepřesnosti reakce. Rovněž není žádoucí, aby Ct hodnoty byly < 10.
• Získané hodnoty využijeme pro výslednou kalkulaci.
—————————————————————————————————————————-—————————————————————————————————————————-——————
PROBLÉMY S REAL-TIME PCR
-Velký rozptyl Ct hodnot v jednotlivých triplikátech
Možné důvody:
• problémy při pipetování – snažte se pipetovat ve větších objemech. Vzorky nanášejte v objemu nejméně 5 μl
• přítomné kontaminanty (fenol, reakční komponenty po syntéze cDNA), které ovlivňují průběh reakce – pokud jsou Ct hodnoty dostatečně nízké (< 28), vzorky více nařeďte, případně reakci purifikujte purifikační kolonkou
• kontaminace cizí DNA při nanášení vzorků na destičku – používejte špičky s filtrem
• nízká účinnost PCR – ověřte účinnost pomocí standardní křivky a případně navrhněte nové primery s lepší účinností
-Nepřirozený tvar amplifikační křivky
Možné důvody:
• přítomné kontaminanty (fenol, reakční komponenty po syntéze cDNA), které ovlivňují průběh reakce – pokud jsou ct hodnoty dostatečně nízké (< 28), vzorky více nařeďte, případně reakci purifikujte purifikační kolonkou,
• příliš vysoká koncentrace výchozí DNA – vzorky více nařeďte.
-Vícevrcholový tvar křivky tání
Možný důvod:
• nespecifické nasedání primerů – zvyšte teplotu nasedání primerů či upravte sekvenci primerů,
• kontaminace cizí DNA při nanášení vzorků na destičku – používejte špičky s filtrem.
-Příliš nízké Ct hodnoty (<10)
• příliš vysoká koncentrace výchozí DNA – vzorky více nařeďte,
• ve spojitosti s rozptylem Ct hodnot replikátů jsou možným důvodem nečistoty ve vzorku.
-Příliš vysoké Ct hodnoty (>35)
• příliš nízká koncentrace výchozí DNA – snižte ředění výchozí DNA, případně výchozí roztok DNA purifikujte přes kolonku a rozpusťte v menším objemu, případně snižte teplotu nasedání primerů.
-Ct hodnoty v negativní kontrole
• značí kontaminaci během přípravy PCR,
• pokud je Ct hodnota v RT(-) kontrole, znamená to kontaminaci genomovou DNA – při přípravě vzorku RNA, zahrňte působení s DNázou, případně použijte primery k různých exonům s dostatečně dlouhým intronem mezi nimi.
