Fragmenty nukleových kyselin lze dle jejich velikosti rozdělit elektroforézou. Elektroforéza využívá rozdílné pohyblivosti jednotlivých fragmentů danou právě jejich rozdílnou velikostí. Nukleová kyselina nese díky záporně nabitým fosfátům záporný náboj, a proto se v elektrickém poli pohybuje od záporného pólu (katody) ke kladnému (anodě).
- Při elektroforéze se separují molekuly nukleových kyselin na základě své délky a konformace.
- Obvykle platí, že delší fragmenty migrují pomaleji než kratší.
- Je využívána gelová elektroforéza, kdy se molekuly nukleových kyselin separují buď v agarosovém či polyakrylamidovém gelu.
———————————————————————————————————————————————————————————————————————————————————————————–
Základní kroky při ELFO
- Příprava agarosového nebo polyakrylamidového gelu. Koncentrace gelu se odvíjí od velikosti separovaných molekul.
- Nanesení vzorků. Vzorky se nanesou do jamek v gelu, které byly vytvořeny pomocí tzv. hřebínku.
- Samotná elektroforetická separace. Migrace v gelu je při elektroforéze kontrolována pomocí barviva přítomného v nanášecím pufru, se kterým je roztok DNA před nanesením na gel smíchán.
- Ukončení elektroforetické separace. Vizualizace separované DNA (nejčastěji obarvení fluorescenčním barvivem a vizualizace pod UV lampou).
———————————————————————————————————————————————————————————————————————————————————————————–
Agarosová ELFO versus polyakrylamidová ELFO (PAGE)
- Pro separaci DNA je vzhledem k menší náročnosti provedení agarosová elektroforéza v porovnání s polyakrylamidovou elektroforézou (PAGE) preferovanou metodou.
- Využití polyakrylamidové versus agarosové elektroforézy se především odvíjí od velikosti fragmentů, které chceme separovat. Polyakrylamidová elektroforéza nastupuje v případech, kdy separujeme krátké fragmenty DNA (cca< 200 bp).
Polyakrylamid (poly(2-propenamid)) je polymer tvořený z akrylamidových podjednotek zesíťovaných N,N‘-methylenbisakrylamidem. Směs akrylamidu a bisakrylamidu polymerizuje při pokojové teplotě pomocí volných radikálů, které dodává persulfát amonným (APS) způsobující homolytické štěpení vazeb O-O. K urychlení polymerizace se používá volná zásada TEMED (tetrametylendiamin), který katalyzuje tvorbu volných radikálů persulfátu amonného. Výběrem vhodné koncentrace akrylamidu a bisakrylamidu lze ovlivňovat velikost pórů gelu a tím délku separovaných molekul. Se zvyšující se koncentrací těchto látek se póry gelu stávají menšími a gel se hodí pro separaci menších molekul, viz tabulka. Pro PAGE je jako elektroforetický pufr využíván TBE. PAGE je buď ve formě denaturační s přídavkem denaturační látky, jako např. močoviny nebo ve formě nedenaturační, tzv. nativní.
![]() Při práci s akrylamidem je třeba obezřetnosti, protože působí jako neurotoxin.
Při práci s akrylamidem je třeba obezřetnosti, protože působí jako neurotoxin.
Agaróza. Standardní agarózová elektroforéza se používá pro separaci fragmentů od 100 bp do 50 kb. Agaróza je lineární sacharidový polymer D-galaktosidázy a 3,6-anhydro-L-galaktopyranozy. Vyrábí se z agaru izolovaného z mořské řasy odstraněním agaropektinu. Ačkoliv by agaróza měla být teoreticky zcela nenabitá, v praxi může obsahovat příměsi nabitých sulfátových či pyruvátových skupin. Tyto skupiny zpomalují pohyb DNA – tento jev se nazývá elektroendoosmóza (EEO). Pro elektroforézu nukleových kyselin jsou preferovány agarózy s nízkou elektroendoosmózou (low EEO). Naopak agarózy s vyšší EEO se používají pro imunoprecipitaci. Na trhu je dostupné široké spektrum agaróz vhodných k jednotlivým typům použití, např. agarózy zajišťující vysoké rozlišení při separaci velmi krátkých fragmentů, agarózy pro separaci pulzní elektroforesou, tzn. velmi dlouhé fragmenty či chromosomální fragmenty či tzv. „low melting“ agarózy, tedy agarózy s bodem táním nižším než je bod tání většiny nukleových kyselin (okolo 650C), které jsou vhodné pro extrakci nukleové kyseliny z gelu.
———————————————————————————————————————————————————————————————————————————————————————————–
Velikost separovaných fragmentů a koncentrace gelu
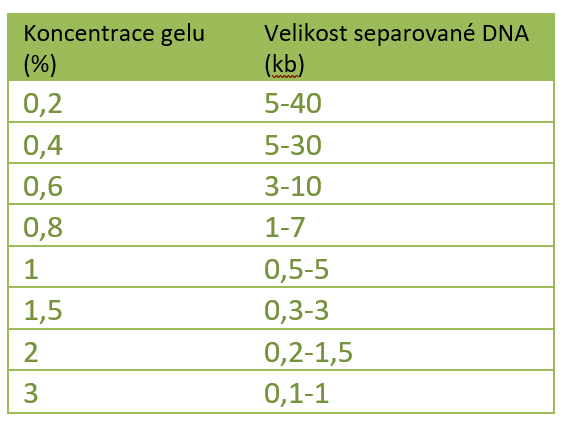
Koncentrace gelu je důležitým faktorem pro mobilitu molekul. Čím koncentrovanější je gel, tím je separace pomalejší, z čehož vyplývá, že vyšší koncentrace zajistí lepší separaci krátkých fragmentů. Koncentrace gelu závisí na typu fragmentů DNA, které chceme separovat. Koncentrace gelu udává velikost pórů v gelu, kterými molekuly DNA procházejí. Koncentrací gelu lze proto ovlivňovat separaci a tedy i rozlišení velikosti fragmentů.
- Vyšší koncentrace gelu zajistí lepší separaci krátkých fragmentů.
- Nižší koncentrace gelu zajistí lepší separaci dlouhých fragmentů.
Standardně pro většinu aplikací je využívaná koncentrace 1%. Nicméně, např. pro kvalitní separaci 5-10 kb DNA fragmentů je využívána 0,7% agarosa, gelem s 2% zajistíme jemnější rozlišení krátkých fragmentů 0,2-1 kb. Pro krátké fragmenty můžeme při použití speciální agarózy o nízkém bodu tání připravit až 4% gel, který umožní rozlišení fragmentů o velikosti okolo 200 bp, lišící se 15 páry bází. Pokud vyžadujeme ještě jemnější rozlišení krátkých fragmentů, musíme použít polyakrylamidový gel a vertikální elektroforézu. Stejně tak i pro kvalitní separaci velmi dlouhých fragmentů je nutné využít speciální elektroforézu, tzv. pulsní elektroforézu (pulse field gel electrophoresis (PFGE)).
———————————————————————————————————————————————————————————————————————————————————————————–
Vliv konformace DNA
Separace molekul nukleových kyselin je významně ovlivněna jejich konformací. Platí, že méně spiralizovaná DNA migruje v gelu pomaleji než superspiralizovaná DNA, která je díky spiralizaci kompaktnější a póry v gelu tak snadněji procházející. Toto lze pozorovat při separaci plasmidové DNA.
———————————————————————————————————————————————————————————————————————————————————————————–
Velikost elektrického napětí při elektroforetické separaci
Optimální velikost elektrického napětí při elektroforéze se udává jako 5-8 V/cm mezi elektrodami u agarózové elektroforézy či 1-8 V/cm u polyakrylamidové elektroforézy. Přitom platí, že
- při nízkém napětí se rychlost migrace proporcionálně mění s elektrickým napětím. Tzn. platí, že s rostoucím elektrickým napětím se nukleové kyseliny pohybují rychleji.
- Od určité hodnoty napětí ovšem také platí, že se zvyšujícím se napětím klesá efektivita separace dlouhých fragmentů a klesá tedy kvalita rozlišení.
- Při příliš vysokém napětí rovněž dochází vlivem produkce tepla k deformaci gelu a tím k nerovnoměrné separaci jednotlivých fragmentů a deformaci proužků.
- Naopak pokud je napětí příliš nízké, je nízká rychlost separace a nukleové kyseliny tak mají tendenci difundovat do okolí, což vede k neostrým, rozmazaným proužkům.
———————————————————————————————————————————————————————————————————————————————————————————–
Elektroforetické pufry
Mobilita při elektroforéze je ovlivněna složením elektroforetického pufru, a to především obsahem solí. Bez přítomnosti solí je elektrická konduktivita minimální a DNA se pohybuje jen velmi stěží. Obsah solí v elektroforetickém pufru musí být optimální. Pokud je příliš vysoký, elektrická konduktivita je vysoká a při elektroforéze dochází k uvolňování velkého množství tepla, což vede k deformaci gelu. Pro agarosovou separaci se standardně používá pufr TAE (Tris-Acetate-EDTA) nebo pufr TBE (Tris-Borate-EDTA).
- Pufr TAE poskytuje rychlejší elektroforetickou separaci lineárních molekul a lepší rozlišení superspiralizované nukleové kyseliny.
- Naproti tomu pufr TBE má silnější pufrovací kapacitu při déle trvajících elektroforézách či elektroforézách běžících při vysokém napětí. Při separaci v polyakrylamidovém gelu se používá TBE.
Disociační pufry: disociační pufry se používají pro rozrušení sekundárních struktur, tj. denaturaci dvouřetězcových molekul, které jsou formovány v případě jednořetězcové nukleové kyseliny. Jako disociační agens se využívá nejčastěji močovina nebo formamid.
———————————————————————————————————————————————————————————————————————————————————————————–
Kontinuální a diskontinuální pufrovací systém
Kontinuální systém. V případě kontinuálního systému je složení pufru, který je použit na přípravu gelu identické s pufrem, který je v elektroforetické vaně. Výsledkem separace při kontinuálním pufrovacím systému jsou proužky separované DNA, které jsou poněkud širší a neostré, vedoucí k poněkud horší kvalitě rozlišení než u diskontinuální pufrovacího systému. Kontinuální systém se používá u většiny aplikací agarosové elektroforézy.
Diskontinuální systém. Diskontinuální systém se využívá především u polyakrylamidové elektroforézy. U tohoto systému je složení pufru mezi gelem a elektroforetickou vanou rozdílné a rovněž na přípravu gelu jsou použity dva různé pufry. Gel je tvořen horním úsekem (blíže ke startu migrace) tzv. „stacking“ gelem o nízké koncentraci akrylamidu a nízkém pH (6,8), a v úseku dále od startu je tzv. separovací gel o vyšším pH (8,8) a vyšší koncentraci akrylamidu. Stacking gel zabraňuje vysokomolekulární DNA, která je ve vzorku přítomná, aby ucpala póry gelu a zabránila tak vstupu nízkomolekulárních molekul. Hlavní výhodou diskontinuálního systému nad kontinuálním systémem je to, že diskontinuální systém toleruje mnohem větší objemy vzorku.
———————————————————————————————————————————————————————————————————————————————————————————–
Nanášecí pufry
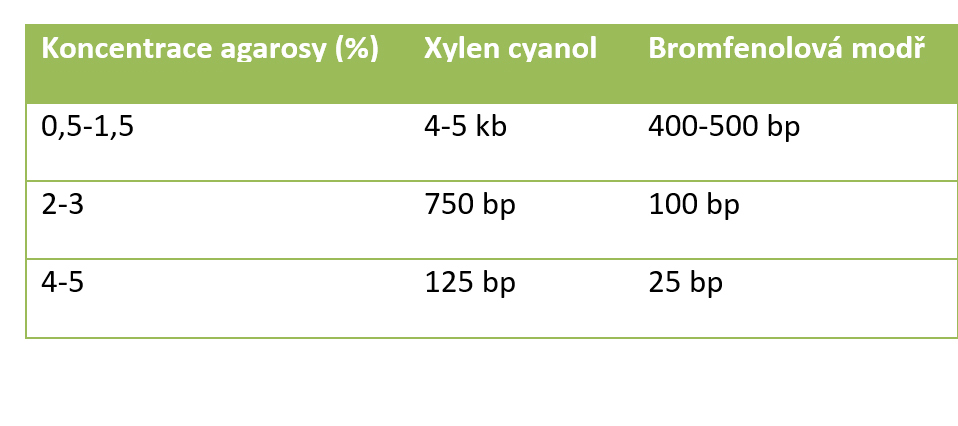
Nanášecí pufry slouží ke snadnějšímu nanesení vzorku do jamek elektroforetického gelu a také kontrole rychlosti průběhu elektroforézy. Nanášecí pufr obsahuje bromfenolovou modř nebo barvivo xylen cyanol. Barvivo obarví testovaný roztok s DNA, což umožní lepší nanášení vzorku na gel a sledování vzorku při separaci. V průběhu elektroforetické separace barvivo migruje gelem. Nanášecí pufr také obsahuje glycerol, který způsobí usazení vzorku na dno jamky gelu. Někdy nanášecí pufr obsahuje i EDTA, která umožní zastavení případné enzymatické reakce. Rychlost migrace barviva v závislosti na koncentraci agarózy je uvedena v tabulce.
Složení nanášecích pufrů můžete najít ZDE.
———————————————————————————————————————————————————————————————————————————————————————————–
Velikostní marker
Velikostní marker (hmotnostní standard, „ladder” ) slouží pro odhad velikosti separovaných fragmentů nukleových kyselin. Jedná se o soubor velikostně definovaných fragmentů. Nanáší se do jedné jamky v gelu paralelně k testovaným vzorkům. Jedná se většinou o plazmidovou DNA štěpenou několika restrikčními enzymy. Např. pro fragmenty s očekávanou velikostí 100 – 1000 bp používáme 100 bp ladder, pro fragmenty od 1 kb do 10 kb používáme 1 kb laddery. Dále jsou k dispozici 2-log laddery, které pokrývají rozsah 100 bp – 10 kb. Existují také laddery pro PFG elektroforézu, tedy velké fragmenty např. kvasinkové DNA. Při separaci RNA se místo DNA markeru používá RNA marker.
———————————————————————————————————————————————————————————————————————————————————————————–
Způsoby vizualizace nukleových kyselin po elektroforetické separaci
Nejběžnějším způsobem vizualizace molekul nukleových kyselin po elektroforetické separaci je jejich obarvení fluorescenčními barvivy. Tradičně je k tomuto využíván etidium bromid (EtBr), v poslední době je to také GelRed či SYBR Green. Ve všech těchto případech se tyto látky navazují na nukleové kyseliny. Z toho plyne, že všechny tyto látky jsou potenciální ![]() mutageny a práce s nimi vyžaduje obezřetnost a striktní dodržování bezpečnosti práce.
mutageny a práce s nimi vyžaduje obezřetnost a striktní dodržování bezpečnosti práce.
Fluorescenční barvivo se přidává buď přímo do gelu při přípravě gelu, nebo se nukleové kyseliny barví až po ukončení elektroforézy, tak, že se gel na cca 10 minut ponoří do lázně s barvivem. Nukleové kyseliny jsou po obarvení fluorescenčními barvivy vizualizovány pod fluorescenční lampou.
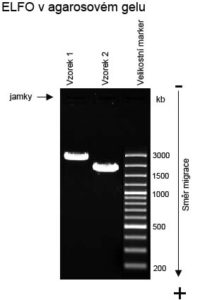
Etidium bromid je k vizualizaci nukleových kyselin využíván nejčastěji. Udává se, že EtBr se vmezeřuje svou plochou molekulou mezi ploché páry bází v molekule DNA, případně do dvouvláknových úseků molekul RNA. Pomocí EtBr je možno po elektroforetické separaci vizualizovat množství DNA v jedné délce o minimálně 20 ng. V určitých případech je třeba brát v potaz, že vazba EtBr na nukleovou kyselinu může měnit její elektroforetickou mobilitu, navázáním etidium bromidu může být totiž ovlivněn náboj a konformace molekul.
Jinou možností vizualizace separovaných molekul je barvení stříbrem, konkrétně působením roztoku nitrátu stříbra či komplexem stříbro-amonium.
Vizualizace může být rovněž docílená hybridizací separovaných molekul se specifickými sondami metodou Southernovy nebo Northernovy hybridizace.
———————————————————————————————————————————————————————————————————————————————————————————–
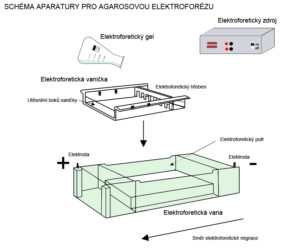
Postup při separaci v agarózovém gelu
Potřeby: zdroj elektrického napětí, elektroforetická vana, vanička, hřebínek, agaróza, elektroforetický pufr TAE nebo TBE, nanášecí pufr, velikostní marker (tzv. ladder).
Příprava gelu a elektroforetické vaničky:
- Množství připravovaného gelu závisí na počtu vzorků a tedy velikosti vaničky a délce hřebínku.
- Koncentrace gelu závisí na typu fragmentů DNA, které chceme separovat, viz tabulka. Pro většinu aplikací se ale používá 1% agarózový gel. Takže např. pro 40 ml 1% agarózového gelu použijeme 40 ml 1X TAE pufru nebo 1X TBE pufru a 0,4 g agarózy.
- Agarózu smícháme s pufrem nejlépe ve skleněné lahvi se šroubovacím víčkem, lahev uzavřeme tak, že je víčko částečně povolené nebo roztok můžeme připravit v Erlenmayerově bance, přičemž hrdlo přikryjeme plastovou folií, kterou perforujeme pro snadnější odchod páry. Velikost lahve musí být cca 2x větší než je objem připravovaného gelu.
- Agarózu nejsnadněji rozpustíme v mikrovlnné troubě, obvykle stačí 1-1,5 min nebo ji lze rozpustit klasicky na plotýnce. V průběhu rozehřívání můžeme 1-2x roztokem zamíchat. Agaróza musí být dokonale rozpuštěna, tzn. nesmí být patrná žádná zrnka tající agarózy.
- Připravený gel necháme zchladnout tak, aby již nebyl vařící, ale přesto dostatečně horký na to, aby nezačal tuhnout. Pokud nám gel nedopatřením ztuhne, můžeme ho opětovně rozpustit.
- Připravíme si ELFO vaničku, jejíž čela jsme předtím důkladně oblepili lepicí páskou či izolepou (v některých případech jsou vaničky dodávány s kovovými pásky, kterými vaničku utěsníme, či je dodáván jiný „utěsňovací“ systém). Do vaničky vložíme ELFO hřeben a vlijeme agarózový gel, který poté necháme dokonale ztuhnout. Po ztuhnutí odstraníme z vaničky utěsnění a vyndáme hřeben.
- Vaničku usadíme do elektroforetické vany, a to tak, aby jamky byly u záporného pólu. Gel s vaničkou zalijeme 1x ELFO (1x TAE nebo 1x TBE) roztokem. Hladina ELFO roztoku by měla být těsně (1-2 mm) nad gelem.
![]() Pozn. V některých laboratořích se přidává do gelu etidium bromid, který nám v závěrečné fázi umožní vizualizaci DNA či RNA. Nicméně, jelikož je etidium bromid mutagen, z bezpečnostního hlediska (kvůli odpařování a kontaminaci laboratorního prostředí) je doporučováno gel barvit až po elektroforéze. Rovněž platí, že etidium bromid nepatrně ovlivňuje mobilitu DNA, což v některých případech experimentů není žádoucí.
Pozn. V některých laboratořích se přidává do gelu etidium bromid, který nám v závěrečné fázi umožní vizualizaci DNA či RNA. Nicméně, jelikož je etidium bromid mutagen, z bezpečnostního hlediska (kvůli odpařování a kontaminaci laboratorního prostředí) je doporučováno gel barvit až po elektroforéze. Rovněž platí, že etidium bromid nepatrně ovlivňuje mobilitu DNA, což v některých případech experimentů není žádoucí.
Příprava vzorků a jejich nanášení:
- Ke vzorkům přidáme nanášecí pufr. Množství dodaného pufru se odvíjí od jeho koncentrace. Pokud je koncentrace nanášecího pufru 10x, ke vzorkům přidáme pufr o objemu jedné desetiny finálního objemu roztoku. Vzorky promícháme.
![]() Je výhodné míchat vzorky s nanášecím pufrem na kousku parafilmu místo klasicky ve zkumavce.
Je výhodné míchat vzorky s nanášecím pufrem na kousku parafilmu místo klasicky ve zkumavce.
- Připravené vzorky naneseme do jamek, přičemž díky přítomnosti glycerolu vzorky klesnou na dno jamky. Aby byly jamky lépe zřetelné, podložíme elektroforetickou vanu tmavým papírem pro snadnější nanášení. Pro nanášení používáme 1-20 µl pipety, které mají obvykle jemnější chod než pipety na větší objemy a nanášení vzorků je s nimi proto snadnější.
- Do jedné z jamek rovněž naneseme hmotnostní marker („size marker“ nebo také „ladder“). Objem nanášeného markeru je doporučován výrobcem.
Separace vzorků:
ELFO vanu přikryjeme víkem a zapneme ELFO zdroj. Nastavíme napětí, a to tak, aby bylo 5-8 V/cm mezi elektrodami. Elektroforézu necháme běžet maximálně tak dlouho až je bromfenolová modř ve 2/3 až ¾ délky vaničky.
Barvení vzorků (pokud nebyla barvička přidaná přímo již do elektroforetického gelu):
- Gel vyjmeme z vaničky a ponoříme ho na 10-20 min do vodného roztoku etidium bromidu (20 µl 1%EtBr ve 100ml H2O), případně GelRed či SyberGreenu.
![]() Zásobní roztok etidium bromidu bývá 1%, tj. 10 mg/ml. Pracovní roztok skladujeme ve tmě a lze jej využívat opakovaně.
Zásobní roztok etidium bromidu bývá 1%, tj. 10 mg/ml. Pracovní roztok skladujeme ve tmě a lze jej využívat opakovaně.
- Během barvení roztokem protřepáváme.
- Po obarvení opatrně gel z barvícího roztoku vyjmeme, opláchneme vodou a vizualizujeme pod UV světlem. Pro zvýšení kontrastu, lze po ukončení ELFO nežádoucí pozadí odstranit promýváním gelu ve vodě po dobu cca 10 min
![]() Při práci s UV světlem používáme ochranu očí proti UV záření, např. speciální štít či brýle.
Při práci s UV světlem používáme ochranu očí proti UV záření, např. speciální štít či brýle.
———————————————————————————————————————————————————————————————————————————————————————————–
Separace v polyakrylamidovém gelu (polyacrylamide gel electrophoresis, PAGE)
Při přípravě polyakrylamidového gelu lze výběrem vhodné koncentrace akrylamidu a bisakrylamidu ovlivňovat velikost pórů gelu a tím optimální separaci fragmentů DNA o určité délce. Se zvyšující se koncentrací těchto látek se póry gelu stávají menšími a gel se hodí pro separaci menších molekul, viz tabulka. Pro PAGE je jako elektroforetický pufr využíván TBE. Složení TBE pufru ZDE.
PAGE je buď ve formě denaturační s přídavkem denaturační látky, jako např. 0,8 M močoviny nebo ve formě nedenaturační, tzv. nativní.
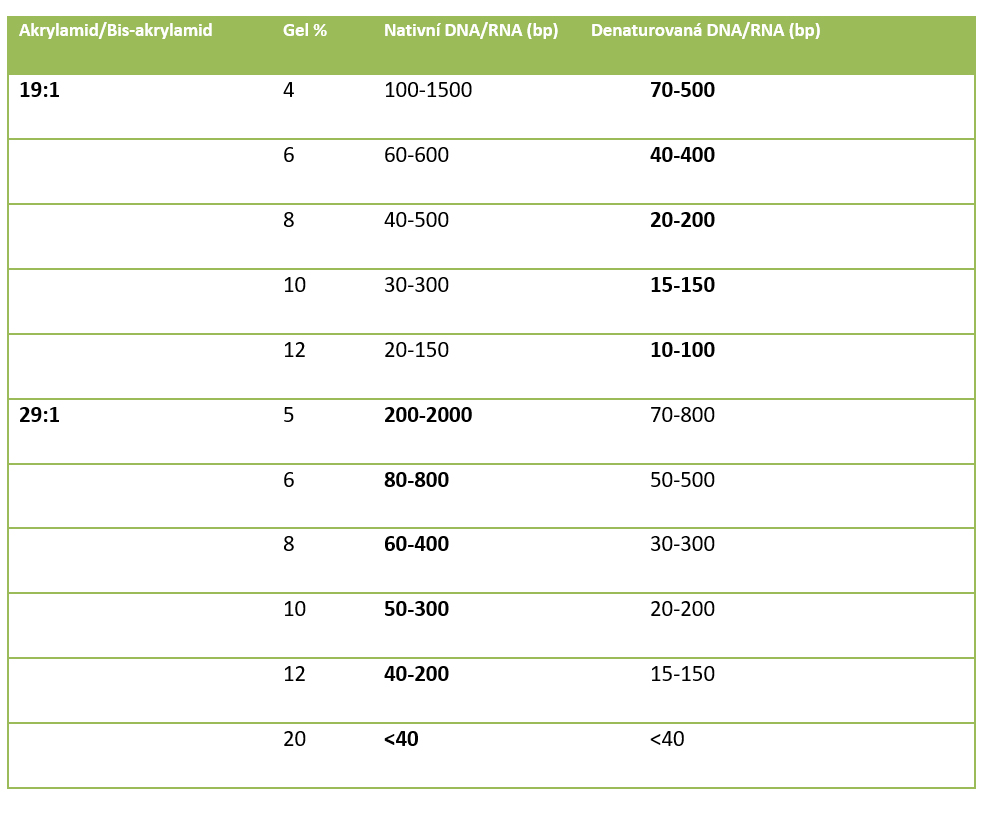
Tabulka. Koncentrace polyakrylamidového gelu pro separaci nukleových kyselin. Doporučené hodnoty pro dané aplikace jsou zvýrazněny tučně.
Příprava elektroforetické aparatury:
- Saponátem a vodou se důkladně umyjí skla, plastové vložky a hřebínek, poté se vše důkladně opláchnou deionizovanou/destilovanou vodou a etanolem a nechá se uschnout.
![]() Se skly se manipuluje jen v rukavicích, přičemž se skla drží za jejich okraje. Skla nesmí být jakkoliv znečištěna, jinak by hrozila tvorba bublin při nalévání gelu.
Se skly se manipuluje jen v rukavicích, přičemž se skla drží za jejich okraje. Skla nesmí být jakkoliv znečištěna, jinak by hrozila tvorba bublin při nalévání gelu.
- Skla se sestaví k sobě, vloží boční vložky, okraje skel se mohou olepit izolepou pro ujištění, že nedojte k vytečení roztoku gelu. Skla se zajistí svorkami a vloží se vertikálně do připravené aparatury.
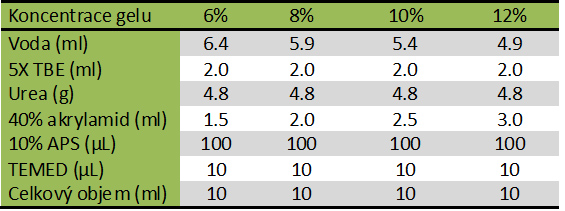
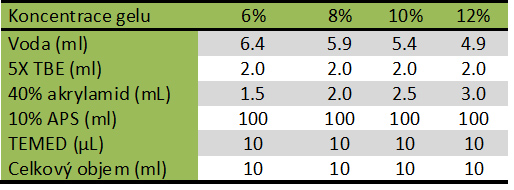
Příprava roztoku gelu s požadovanou koncentrací (viz tabulka dole):
- Odměří se požadovaný objem vody.
- Pokud se připravuje denaturační gel, přidá se močovina, tak aby její finální koncentrace byla 0,8 M.Přičemž se roztok důkladně promíchá a ujistíme se, že je močovina důkladně rozpuštěná.
- Do roztoku se přidá množství akrylamidu/bisakrylamidu dle požadované koncentrace gelu (viz tabulka nahoře).
- Přidá se TBE, tak aby jeho finální koncentrace byla 1X.
- Přidá se APS, tak aby jeho finální koncentrace byla 0,05 %. Roztok důkladně promíchejte.
- Nakonec se přidá TEMED, tak aby jeho finální koncentrace byla 0,05 %. Rychle a důkladně promícháme. Po přidání TEMEDu pracujeme urychleně, protože již začíná polymerizace.
- Pipetou naneseme roztok mezi připravená skla a vložme hřebínek. Ujistíme se, že nedochází k vytékání roztoku. Necháme polymerizovat 30-60 min při pokojové teplotě.
- Po ukončení polymerizace, odstraníme svorky, případně izolepu, vložíme do aparatury a vlijeme elektroforetický pufr TBE.
- Opatrně odstraníme hřebínek a ihned pipetou s tenkou špičkou důkladně propláchneme jamky, tak aby se odstranily zbytky nezpolymerizovaného roztoku, který zůstal v jamkách a výsledné proužky tak byly rovné. Necháme běžet elektroforézu naprázdno, tj. bez vzorků 15-30 min při 1-8 V/cm.
- Smícháme roztok nukleové kyseliny s nanášecím pufrem a tenkou špičkou naneste vzorky. Naneseme velikostní marker. Necháme elektroforézu běžet při 1-8 V/cm tak dlouho, až se barvička nanášecího pufru dostane do požadované vzdálenosti (obvykle 2/3 – 3/4 délky gelu).
- Vypneme elektroforézu, odstraníme boční vložky a oddělíme skla od sebe pomocí vložení plastového či kovového „klínku“ (např. staré platební karty). Opatrně sundáme gel a necháme jej barvit např. pomocí etidium bromidu.
Složení gelu pro denaturační PAGE
Složení gelu pro nativní PAGE
![]() Při práci s akrylamidem je třeba obezřetnosti, protože působí jako neurotoxin.
Při práci s akrylamidem je třeba obezřetnosti, protože působí jako neurotoxin.
![]() Je důležité používat TBE ze stejné lahve pro přípravu gelu a tak jako pufr do elektroforetické vany. Malé rozdíly v koncentraci solí mohou mít velký vliv na migraci nukleové kyseliny.
Je důležité používat TBE ze stejné lahve pro přípravu gelu a tak jako pufr do elektroforetické vany. Malé rozdíly v koncentraci solí mohou mít velký vliv na migraci nukleové kyseliny.
———————————————————————————————————————————————————————————————————————————————————————————–
SPECIÁLNÍ DRUHY ELEKTROFORÉZ
Pulzní gelová elektroforéza (Pulse field gel electrophoresis, PFGE) se používá pro separaci velkých fragmentů (nad 50 kb). Při ní je periodicky měněna orientace elektrického pole, přičemž reorientace je u větších molekul pomalejší. Důležité je, aby DNA byla kompletně deproteinizovaná působením proteinázy K.
Gelová zpomalovací analýza (Electrophoretic mobility shift assay, EMSA) využívá snížení mobility DNA po vazbě s proteinem a používá se pro studium interakcí DNA s proteiny.
Denaturační gelová elektroforéza (denaturing gradient gel electrophoresis, DGGE) se používá pro detekci rozdílů v sekvenci krátkých molekul DNA. Využívá různé elektroforetické mobility normální a částečně denaturované DNA, tedy DNA s rozvolněnými vodíkovými můstky. Denaturace DNA lze dosáhnout přidáním močoviny nebo formamidu do gelu, případně vytvořením teplotního gradientu.
