PUFRY A pH
Vhodné pH v biologických systémech
Biologické systémy jsou extrémně citlivé ke změnám pH. Změny pH či jeho nevhodná hodnota může vést k falešným výsledkům laboratorních experimentů či nefungování experimentálních procedur. Udržení vhodného pH na jeho stabilní úrovni je pro experimentální činnost mnohdy zásadní. Většina biologických systémů vyžaduje pH mezi 6-8.
Čím je dáno pH?
pH roztoku se odvíjí od koncentrace vodíkových (H+) a hydroxylových (OH-) iontů. Pokud je koncentrace obou iontů stejná, roztok je neutrální. Pokud koncentrace vodíkových iontů převýší koncentraci iontů hydroxylových, pak je roztok kyselý (pH<7), naopak pokud v roztoku převyšuje koncentrace hydroxylových iontů, pH je zásadité (pH>7).
Kyselinu definujeme jako donor vodíkových iontů, zásadu naopak jako akceptor vodíkových iontů. A protože pufry jsou schopny uvolňovat nebo naopak vázat vodíkové ionty, jsou využívány k udržování pH roztoku.
Kyselina se obecně označuje jako HA. Po odštěpení vodíkového iontu (protonu) z kyseliny HA vzniká molekula A–, označovaná jako konjugovaná zásada. Nebo naopak můžeme A– označit za zásadu a HA za její konjugovanou kyselinu.
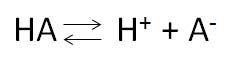
Pufry
Pufry jsou obvykle směsi slabých kyselin a jejich konjugovaných zásad (např. směs kyseliny octové a octanu sodného), nebo směsi slabých zásad a jejich konjugovaných kyselin (např. směs hydroxidu amonného a chloridu amonného). Jedná se o dvojici látek, které přecházejí jedna ve druhou příjmem/ztrátou jednoho protonu. Slabé kyseliny a slabé zásady ve vodném roztoku disociují jen částečně, a proto se v roztoku vyskytují jako disociované a nedisociované formy, mezi kterými existuje rovnováha. Nedisociované formy jsou k dispozici pro případ, že do systému vstoupí látka o jiném pH. Pokud se tak stane, dochází k jejich disociaci, a tím k úpravě pH.
Kyseliny a zásady jsou v pufru ve spřažené, konjugované soustavě a schopnost pufru udržovat pH vyplývá z dostatečné koncentrace obou složek konjugovaného páru. Kyselina pufru zabrání zvýšení pH, pokud do roztoku přidáme zásadu, naopak zásada pufru zabrání snížení pH, pokud přidáme kyselinu.
Hodnota pH pufru závisí na vzájemném poměru koncentrací obou složek a disociační konstantě, která vyjadřuje ochotu k disociaci. Je vyjádřena Henderson-Hasselbalchovou rovnicí:
pH = pK + log [konjugovaná baze] / [kyselina]
Pufry nejlépe fungují při pH = pK ± 1.
Účinnost pufru je charakterizována pufrační kapacitou β, která je definována poměrem přídavku silné zásady, resp. silné kyseliny k příslušné změně pH pufru (čím více je třeba přidat látkové množství hydroxidu, resp. kyseliny, do 1 litru pufru tak, aby nastalo určité zvýšení, resp. snížení pH, tím lepší je pufr).
Vliv teploty na pH pufru
Teplota může pH pufru ovlivnit velmi výrazně, a to zvlášť pokud pufry obsahují reaktivní aminové skupiny, jako je např. u Trisu. Při 4 °C může mít pufr pH 7, ale tentýž roztok má při 37 °C pH 5,95. Tzn. pokud upravujete pH pufru, dělejte to při teplotě, při které budete provádět váš experiment. A pokud váš experiment zahrnuje změnu teplot, vyberte pufr, který umožňuje posun v disociaci.
Vliv ředění na pH pufru
Hodnota pH pufru závisí na vzájemném poměru koncentrací složek konjugovaného páru, proto mírným ředěním by správně pH pufru nemělo být zásadně ovlivněno. Nicméně neplatí to vždy. Příkladem je Tris, u něhož, pokud ředíme jeho zásobní roztok 10x, dochází ke snížení pH o 0,1. Významná změna pH může nastat při razantnějším ředění, kdy je překročen optimální pufrovací rozsah (což je u Tris pH 7,3 – 9,3 při 20 °C).
Kritéria pro výběr vhodného pufru při biologickém výzkumu
V současné době je známa celá škála pufrů, které jsou vhodné pro různé biologické systémy. Nicméně povědomost o vhodnosti/nevhodnosti pufrů pro biologické experimenty není tak stará a sahá teprve do roku 1966. Tehdy Prof. Norman Good z Michigan State University publikoval práci, kde představil kritéria vhodných pufrů a publikoval 20 různých pufrů, které těmto kritériím odpovídají.
Dle kritérií vytvořených Goodem je vhodnost pufru daná:
• pK mezi 6-8. pK pufru by mělo být mezi 6-8, protože většina biochemických experimentů vyžaduje rozsah pH 6-8.
• Toxicita. Pufr nesmí být v daném biologickém systému toxický.
• Rozpustnost pufru ve vodě. Pufr by měl být vysoce rozpustný ve vodě.
• Omezená permeabilita biologickými membránami. Významná prostupnost pufru biologickými membránami vede k disproporční akumulaci pufru v subcelulárních prostorech. Biologické membrány nejsou permeabilní pro obojetné pufry (tj. pufry, které nesou pozitivní a negativní náboje na různých atomech v molekuly, např. MOPS a HEPES).
• Inertnost. Pufr nesmí ovlivňovat studované biochemické reakce a interagovat s kritickými reakčními komponentami. Např., protože je citrát chelátorem vápníku, nelze citrátové pufry využít při reakcích, kde jednou z komponent je vápník. Dalším příkladem jsou aminové skupiny v Trisu, které reagují s DEPC využívaným při inaktivaci RNáz. Obdobně s DEPC reaguje HEPES. Proto v pufrech Tris a HEPES nelze použít působení DEPC.
• Minimální vliv koncentrace a teploty na disociaci. To znamená, že při ředění zásobního pufru by nemělo docházet k výrazným změnám pH pufru.
• Chemická stabilita. Pufry by měly být při experimentálních podmínkách stabilní.
• Absorbance. Pufr by neměl výrazně absorbovat UV při vlnových délkách, které jsou využívány např. pro spektrofotometrické vyhodnocování vzorku.
Literatura:
Good, N.E., et al. (1966) Hydrogen Ion Buffers for Biological Research. Biochemistry 5(2), 467-477.
www.promega.com
Kubíček (2010) Výpočty z fyzikální chemie. Karolinu. Praha. 978-80-246-1806-7.
