Sonda je jednořetězcový nebo dvouřetězcový fragment nukleové kyseliny, který se na základě komplementarity bází navazuje k příslušným, tzv. komplementárním úsekům cílové DNA či RNA. Po navázání je sonda vizualizována. Navázání sondy k dané sekvenci a její vizualizace poskytne informaci o přítomnosti/nepřítomnosti sekvence ve vzorku či také informaci o kvantitě testované sekvence. Vizualizaci sondy umožní její značení.
Dle molekuly nukleové kyseliny sondy rozlišujeme:
- dvouřetězcové molekuly DNA
- jednořetězcové molekuly DNA
- molekuly RNA
- syntetické oligonukleotidy
Dle typu značení sondy rozlišujeme:
- neradioaktivní sondy
- radioaktivní sondy
Výběr vhodné sondy a jejího značení závisí na požadavcích na citlivost detekce sondy, potřebě kvantifikace, ale také na přístrojovém vybavení.
—————————————————————————————————————————————————————————————————————————————————————-
RADIOAKTIVNÍ SONDY
Radioaktivní značení poskytuje ze všech v současné době dostupných značících systémů stále tu nejcitlivější detekci sondy. Radioaktivním značením je možno detekovat až 10 fg cílové nukleové kyseliny. Při radioaktivním značení je sonda značena inkorporací 32P, 33P nebo 35S. Výběr radioizotopu je dán požadavky na citlivost detekce a rozlišení signálů. Takže např. 32P poskytuje pro svou vysokou energii vysokou citlivost detekce, ovšem rozlišení při detekci je proto také nižší. Naopak 33P s nižší energií umožní nižší citlivost a delší dobu expozice, ale zato vyšší rozlišení signálů.
NERADIOAKTIVNÍ SONDY
Nespornou výhodou neradioaktivního značícího systému je snížení bezpečnostních rizik při práci se značenou sondou, také eliminace problému s uskladňováním radioaktivního odpadu. Výhodou je také stabilita značených sond, protože neradioaktivně značené sondy jsou stabilní nejméně šest měsíců a de facto mohou být pro dané experimenty k dispozici neustále po dlouhou dobu. Citlivost moderních neradioaktivních značících systémů je udávána až k 50 fg cílové molekuly. Neradioaktivní sondy poskytují buď přímou, nebo nepřímou detekci.
•Nepřímá detekce. Při nepřímé detekci mohou být sondy konjugovány s vhodným proteinem, který je v následné imunologické reakci detekován příslušnou protilátkou. Protilátka je konjugovaná buď s fluorochromem vedoucí k fluorescenčnímu signálu, nebo může být také konjugována s enzymem (např. alkalickou fosfatázou nebo křenovou peroxidázou), který po přídavku vhodného substrátu s tímto substrátem reaguje, což vede k chemiluminiscenční, chemifluorescenční či kolorimetrické reakci. Příkladem tohoto systému jsou sondy značené digoxigeninem (DIG), což je steroid produkovaný výhradně rostlinami rodu Digitalis. Molekuly DIG jsou detekovány protilátkou (anti-digoxigeninem), která nese navázaný enzym pro reakci se substrátem. Často využívaným systémem pro nepřímou detekci je také interakce mezi biotinem a avidinem či streptavidinem.
-Biotin je vitamín H, který je přítomný ve všech živých buňkách a je důležitý pro celou řadu biologických procesů. Významně je zastoupen v určitých živočišných a rostlinných tkáních, jako jsou játra, krev, mozek, vaječný žloutek nebo kukuřičná zrna. Biotin umožňuje vysoce specifickou interakci s biotin-vazebnými proteiny, jako je avidin či streptavidin.
-Avidin je protein, který je získáván především z vajíček ptáků a plazů. Vykazuje silnou afinitu k biotinu. Vazba mezi biotinem a avidinem je považovaná za dosud nejsilnější, nekovalentní interakci mezi proteinem a ligandem. Formace vazby je velmi rychlá, přičemž vzniklá vazba není narušena ani působením extrémního pH, teploty, denaturujících látek či organických rozpouštědel. Avidin je schopen vazby až ke čtyřem molekulám biotinu najednou.
-Streptavidin je tetramerní biotin-vazebný protein izolovaný ze Streptomyces avidinii. Stejně jako avidin, streptavidin vykazuje silnou vazbu k biotinu.
•Přímá detekce. Přímá detekce je umožněna v případech, kdy je enzym pro chemiluminiscenční či kolorimetrickou reakci navázán přímo na sondu. Alternativně mohou být sondy značeny přímo fluorochromy, které poskytují emisi fluorescenčního signálu.
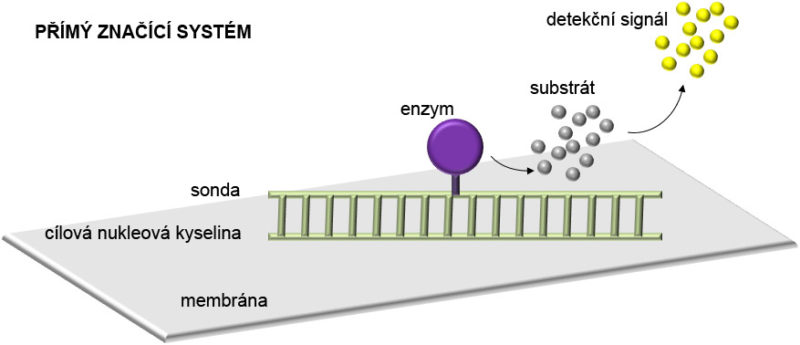
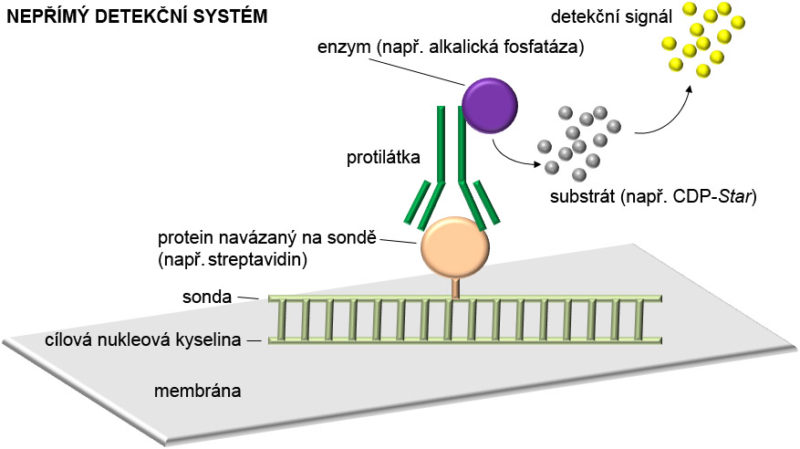
Substráty pro neradioaktivní detekci
ECL. Substrát ECL je využíván u detekčních systémů s křenovou peroxidázou, přičemž detekovaná molekula je zastoupena alespoň v 500 fg. Reakce ECL s křenovou peroxidázou vede k chemiluminiscenční reakci.
CDP-Star. Tento substrát je využíván pro chemiluminiscenční reakci s alkalickou fosfatázou. Je využíván zejména při Southernově a Northernově hybridizaci.
ECF. Substrát ECF je využíván k reakci s alkalickou fosfatázou. Výsledkem reakce je fluorescenční produkt. Substrát ECF je využíván při aplikacích, kdy jedním ze záměrů je kvantifikace cílové molekuly.
ZPŮSOBY ZNAČENÍ SONDY
Pro běžné laboratorní účely jsou pro značení sondy využívány především enzymatické reakce. Existuje několik způsobů, jak sondu označit.
Existuje tzv. koncové značení, kdy se značka přidává na 3’ nebo 5’ konec sondy, nebo naopak průběžné značení, kterým se značka inkorporuje do sondy po celé její délce.
Pro enzymatické značení jsou využívány tyto enzymy:
Terminální deoxynukleotidyl transferáza (TdT) je DNA polymeráza, která přidává deoxynukleotidy k 3’ koncům molekuly DNA. Používá se pro koncové značení sondy. Nejvyšší aktivitu enzym vykazuje na 3’ koncích jednořetězcové DNA, nižší aktivita je na 3’ přečnívajících koncích dvouřetězcové DNA. Velmi nízká aktivita je na tupých koncích dvouřetězcové DNA a na 5’ přečnívajících koncích DNA. Nejčastějším využitím TdT pro značení sond je značení jednořetězcových PCR primerů nebo i také značení dvouřetězcových fragmentů DNA s 3’ převisy po restrikčním štěpení. Je využívána jak pro radioaktivní, tak neradioaktivní značení.
T4 RNA ligáza. Jedná se o enzym kódovaný v genomu T4 bakteriofága. Protože T4 RNA ligáza katalyzuje připojení terminálního 5’-fosfátu ke koncové 3’- hydroxylové skupině na RNA, je využívaná pro radioaktivní značení 3’ konce RNA s [5′ ³²P]pCp (cytidin-3′,5′-bis-fosfát) nebo také neradioaktivní značení s vhodně modifikovaným nucleosid 3′,5′-bisfosfátem.
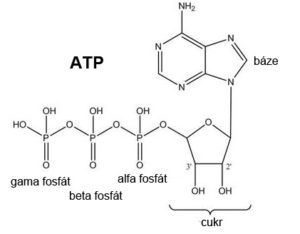
T4 polynukleotid kináza (PNK). Jedná se o enzym kódovaný v genomu T4 bakteriofága. Používá se pro koncové značení sondy. PNK přenáší z ATP fosfát, který je v pozici gama, na 5’- hydroxylovou skupinu DNA nebo RNA. Enzym je aktivní především na jednořetězcových molekulách nukleové kyseliny nebo na 5’ převisech u dvouřetězcové nukleové kyseliny. PNK je využívána především pro radioaktivní značení 5’ konců radioaktivním značením, kdy gama fosfát z ATP obsahuje radioaktivní fosfor (γ-32P nebo γ-33P).
DNA polymerázy. DNA polymerázy jsou enzymy, které zajišťují syntézu DNA. Rozlišujeme DNA-dependentní DNA polymerázy, které jako templát využívají DNA, a RNA-dependentní DNA polymerázy (tzv. reverzní transkriptázy), které využívají jako templát RNA. DNA polymerázy přisedají k jednořetězcovému úseku DNA či RNA, podle kterého tvoří nový řetězec, a který takto funguje jako tzv. templát. DNA polymeráza začíná syntézu od krátkého oligonukleotidu (tzv. primeru), který je díky komplementaritě přisedlý k templátovému řetězci. DNA polymeráza přidá k 3’ konci tohoto primeru dle templátového řetězce příslušný deoxyribonukleotid (dNTP) a syntéza DNA se rozjíždí postupným přidáváním dalších dNTP. Jednotlivé dNTP jsou pospojovány prostřednictvím fosfodiesterových vazeb, které se vytváří mezi fosfátovou skupinou jednoho deoxyribonukleotidu a 3’ uhlíkem druhého deoxyribonukleotidu. Díky tomuto mechanismu se syntetizovaný řetězec prodlužuje ve směru 5’→3′.
Co se týče značení sond, jsou DNA polymerázy nejčastěji využívány k průběžnému, náhodnému značení, kdy jsou v průběhu syntézy DNA dodávány značené dNTP. Nukleotidy mohou být značeny radioaktivně i neradioaktivně. K neradioaktivnímu značení se obvykle využívá digoxigenin, biotin nebo také fluorochromy. Nejčastěji jsou k průběžnému značení využívány metody „random primed labeling“ a nick-translace. Průběžně značené sondy mají vysokou specifickou aktivitu a jsou schopny vizualizovat i malé množství cílové molekuly. DNA polymerázy mohou být také ovšem využity ke koncovému značení pomocí PCR, kdy je pro značení 5’ konce sondy využit značený primer.
RNA polymerázy. Jedná se o enzymy, které vytváří vlákno RNA. Krom toho, že jsou templát-dependentní, jsou i sekvenčně-dependentní, tzn. vyžadují určitou (promotorovou) sekvenci, na kterou se enzym před zahájením vlastní syntézy k templátu navazuje. K laboratorním účelům se využívají při in vitro syntéze mRNA. Jsou využívány k syntéze RNA sond, kdy se pro syntézu dodají modifikované nukleotidy. Nejčastěji je využíváno radioaktivní značení. Nicméně může být využíváno i značení neradioaktivní.
METODY PRŮBĚŽNÉHO ZNAČENÍ
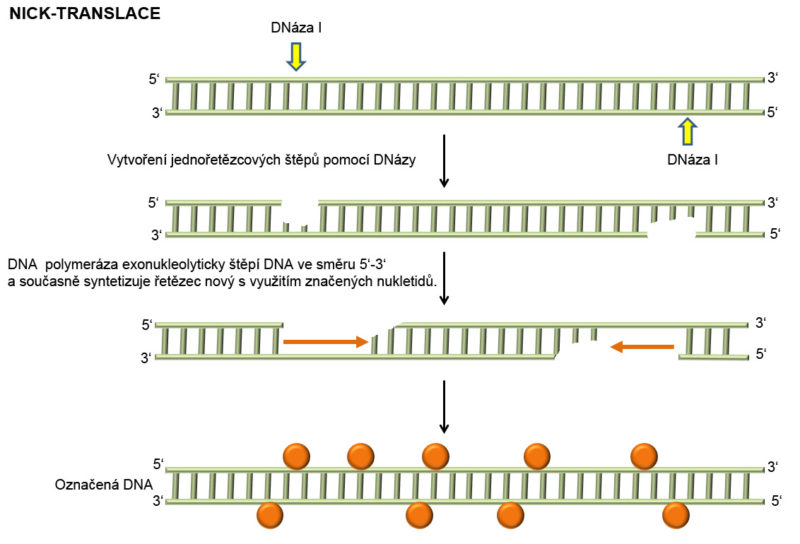
Nick-translace. Jedná se o metodu průběžného značení sondy. V prvním kroku dochází na molekule DNA působením DNázy I k vytvoření jednořetězcových štěpů. K těmto štěpům přisedá DNA polymeráza I, která má kromě polymerázové aktivity i 5’-3’ exonukleázovou aktivitu. Tato exonukleázová je směrovaná k úseku DNA, který leží ve směru syntézy, tzn. DNA polymeráza tento úsek nejprve rozloží a poté na jeho místě nasyntetizuje nový, přičemž pro syntézu řetězce využívá značených nukleotidů.
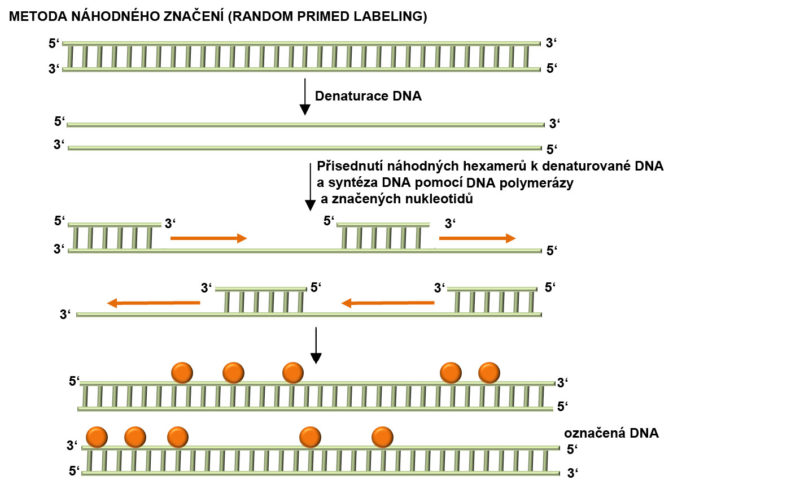
Metoda náhodného značení (Random-primed labeling). Jedná se o metodu průběžného značení sondy. V prvním kroku je značná DNA denaturovaná, tj. dochází k vytvoření jednovláknových molekul. K těmto molekulám přisedají náhodné hexanukleotidy, které poté fungují jako primery pro iniciaci syntézy DNA polymerázou. DNA polymeráza přisedá k templátové molekule, syntetizuje nový řetězec, přičemž při syntéze využívá značených nukleotidů.
Literatura:
Kaufmann et al. (1987) Anal Biochem. 161, 89-95.
Amersham Biosciences (1997) Technical Tips.
Thermo Scientific Avidin-Biotin Technical Handbook
Eisel et al. (2002). DIG Application Manual for Nonradioactive in situ Hybridization (3rd ed.). Penzberg: Roche Diagnostics.
Kessler (1991) Molecular and Cellular Probes. 5(3), 161–205.
