Pokud látka absorbuje určitou energii, dochází k přeskoku jejich elektronů z nižší energetické hladiny na vyšší energetickou hladinu, a tím dochází k excitaci atomu. Excitovaný stav není stabilní, a tak vzápětí dochází k deexcitaci, to jest k přeskoku elektronů zpět na původní hladinu. Přičemž je uvolněna přebytečná energie, a to v podobě světelné energie, tepla nebo jinou formou. Jedním z projevů deexitace atomů je luminiscence.
LUMINISCENCE
Luminiscence je emise světelného záření dané látky, které výrazně převyšuje její tepelné záření. Luminiscence je vyzařování světla látkou, aniž by byla tato látka zahřátá, tzn. dochází k vyzařování studeného světla. Luminiscence může být vyvolána různými zdroji, a proto rozlišujeme např. chemiluminiscenci (je vyvolána chemickou reakcí), fotoluminiscenci (je vyvolána elektromagnetickým zářením) nebo elektroluminiscenci (je vyvolána elektrickým polem). Luminiscence vyvolaná světelným zářením z oblasti viditelného světla nebo pomocí UV záření se dělí na fluorescenci a fosforescenci.
FLUORESCENCE A FOSFORESCENCE
Luminiscenci rozlišujeme na fluorescenci a fosforescenci. K fluorescenci dochází, pokud emise záření z excitovaného elektronového stavu nastává jedním či více spontánními energetickými přechody. V případě fluorescence je vyzáření světla po excitaci velmi rychlé, a to v řádu několika nanosekund. Pokud odstraníme zdroj ozařování, fluorescence ihned vymizí.
Fosforescence je charakterizovaná tím, že k emisi záření dochází pomalu, a to proto, že elektrony jsou v metastabilním stavu, tzn. dostávají se na takové energetické hladiny, z nichž se nemohou snadno vrátit na základní hladinu. V případě fosforescence proto emise záření přetrvává po určitou dobu po odstranění zdroje ozařování.
Mezi fluorescencí a fosforescencí tedy platí jiná doba dohasínání. Doba dohasínání je průměrný čas, kdy je molekula v excitovaném stavu předtím, než dochází k emisi záření. Doba dohasínání u fluorescence je < 10-8, doba dohasínání u fosforescence je > 10-8.
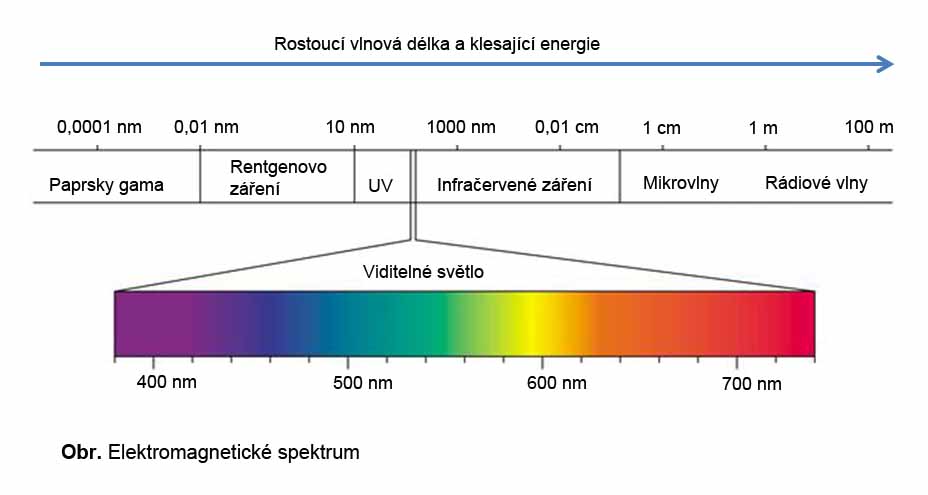
ELEKTROMAGNETICKÉ SPEKTRUM A VIDITELNÉ SVĚTLO
Elektromagnetické spektrum udává rozsah frekvencí, vlnových délek a energií elektromagnetického záření. Součástí elektromagnetického záření je i viditelné světlo, které je detekovatelné lidským okem a které je tvořené vlnovými délkami o rozsahu 400 nm až 740 nm. V elektromagnetickém spektru se viditelné světlo nachází mezi ultrafialovým světlem (s kratšími vlnovými délkami) a infračerveným světlem (s delšími vlnovými délkami). Viditelné světlo tvoří v elektromagnetickém spektru tzv. světelné spektrum, které je zastoupeno jednotlivými barvami (spektrálními barvami). Jednotlivým barvám odpovídá vlnová délka a energie daného záření. Stejně tak jako v celém elektromagnetickém spektru, i u viditelného světla platí, že se zvyšující se energií klesá vlnová délka.
FLUOROCHROMY
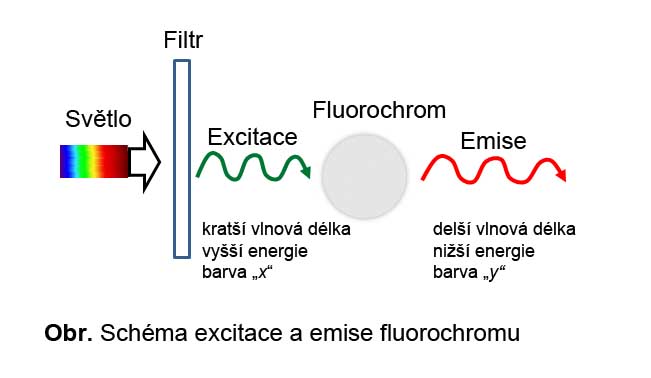 Fluorochromy (nebo také fluorofory či fluorescenční barviva) jsou jakékoliv látky, které, pokud jsou ozářeny světlem o určité vlnové délce (z viditelné či UV oblasti), jsou poté schopny světlo vyzářit zpátky. Absorbcí světla totiž u nich dochází k excitaci elektronů, po jejichž návratu do základního stavu je přebytečná energie vyzářena formou světla. To vede k tomu, že fluorochrom v excitačním světle září. Emitované záření je o nižší energii a delší vlnové délce, než jaká byla u excitačního záření.
Fluorochromy (nebo také fluorofory či fluorescenční barviva) jsou jakékoliv látky, které, pokud jsou ozářeny světlem o určité vlnové délce (z viditelné či UV oblasti), jsou poté schopny světlo vyzářit zpátky. Absorbcí světla totiž u nich dochází k excitaci elektronů, po jejichž návratu do základního stavu je přebytečná energie vyzářena formou světla. To vede k tomu, že fluorochrom v excitačním světle září. Emitované záření je o nižší energii a delší vlnové délce, než jaká byla u excitačního záření.
Abychom mohli pozorovat pouze fluoreskující strukturu, tzn. pouze světlo emitované fluorochromem a tedy světlo jen o určité vlnové délce, je třeba nežádoucí vlnové délky odstranit. Eliminace nechtěných vlnových délek se děje prostřednictvím patřičných filtrů, které jsou schopny propustit světlo jen o určité vlnové délce.
VLASTNÍ A NEVLASTNÍ FLUOROCHROMY, AUTOFLUORESCENCE
Fluorochromy jsou rozlišovány na vlastní a nevlastní. Vlastní fluorochromy jsou zodpovědné za přirozenou, tzv. autofluorescenci vzorku, kdy vzorek vykazuje určitou míru fluorescence, protože sám o sobě obsahuje nějaké fluorochromy. Zdrojem autofluorescence jsou proteiny s především aromatickými aminokyselinami tryptofanem, tyrosinem a fenylalaninem. Autofluorescenci dále vykazuje např. chloforyl, hemoglobin, cytochromy, vitamin A či redukované formy NADH a NADPH. Většina fluorochromů vyskytujících se v přírodě má široký rozsah vlnových délek excitačního a emisního záření. Proto jsou pro biologický výzkum využívány tzv. nevlastní fluorochromy, které se uměle zavedou do studovaného systému a které nesou jasně definované excitační a emisní maxima.
Nevlastní fluorochromy se po přidání do systému váží na cílové struktury, a to buď kovalentně (jedná se potom o tzv. fluorescenční značky) nebo nekovalentně (jedná se o fluorescenční sondy). Využitím komerčně dostupných fluorochromů je nejčastěji studovaná přítomnost proteinů a nukleových kyselin, a to jak in vitro, in situ, tak in vivo.
CHARAKTERISTIKY FLUOROCHROMŮ
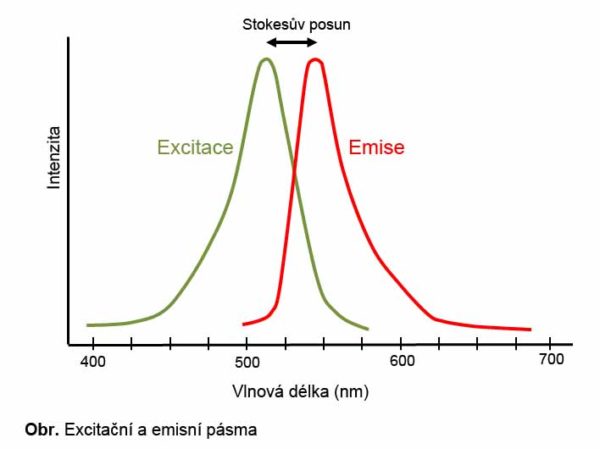
Excitační a emisní pásmo.
Každý fluorochrom má svá charakteristická excitační a emisní pásma. Excitační pásmo ukazuje rozsah vlnových délek, které vedou k excitaci dané látky. Emisní pásmo ukazuje rozsah vlnových délek, při kterém dochází k emisi fluorescence. Jak excitační, tak emisní pásma mají svá maxima, což znamená, že pokud je fluorochrom ozářen světlem o vlnové délce, která odpovídá maximu excitačního pásma, následná fluorescence nabývá maximální intenzity. Pokud je použita jiná vlnová délka, intenzita fluorescence je snížená. Rozdíl mezi vlnovými délkami emisního a excitačního maxima se nazývá Stokesův posun. Stokesův posun je důležitým faktorem při biologických experimentech. Pokud je Stokesův posun velmi malý, je obtížné odlišit emitované světlo od excitačního. Při „vícebarevných” experimentech s více fluorochromy je třeba při výběru fluorochromů brát zřetel na možný překryv jejich spekter.
Barva fluorochromu. Excitační a emisní záření dané látky se liší svými vlnovými délkami (emisní záření má delší vlnovou délku než excitační) a tudíž se liší i svou barvou. Např. pokud je GFP (Green fluorescent protein) ozářen světlem z modré až UV oblasti (maximum při 395 nm), fluoreskuje jasně zelenou barvou (maximum při 509 nm). Fluorochrom DAPI (4′,6-diamidino-2-phenylindole) je excitován UV zářením (maximum při 358 nm) a poskytuje fluorescenci z modrého spektra (maximum při 461 nm).
Extinkční koeficient. Extinkční koeficient vyjadřuje kvantitu absorbovaného světla o určité vlnové délce při dané koncentraci fluorochromu v látce.
Kvantový výtěžek. Vyjadřuje efektivitu fluorescenční emise a je vyjádřen jako poměr emitovaných fotonů k fotonům absorbovaných (pohybuje se mezi 0-1).
Životnost. Doba, po kterou je molekula v excitovaném stavu, než dojde k emisi záření (obvykle 0,2 – 20 nanosekund).
PŘEKRYV SPEKTER
Problém s překryvem spekter fluorochromů nastává, pokud v experimentu používáme, tj. excitujeme a detekujeme, několik fluorochromů v jednom okamžiku najednou (tzv. vícebarevné experimenty). Jedná se o překryvy excitačního a emisního spektra.
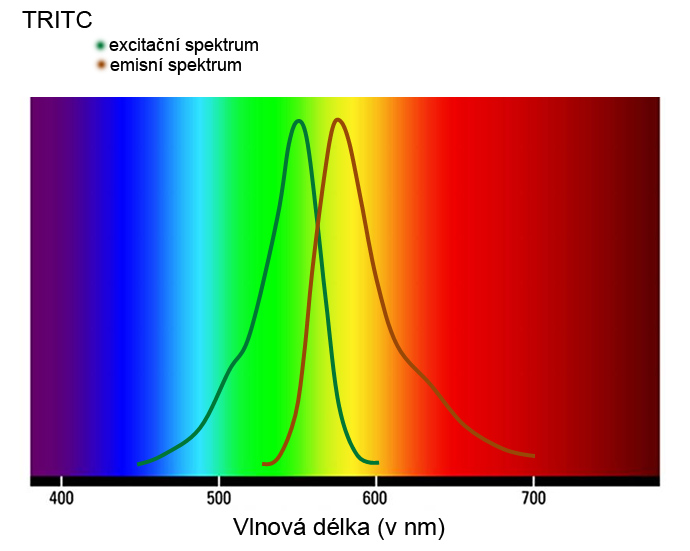
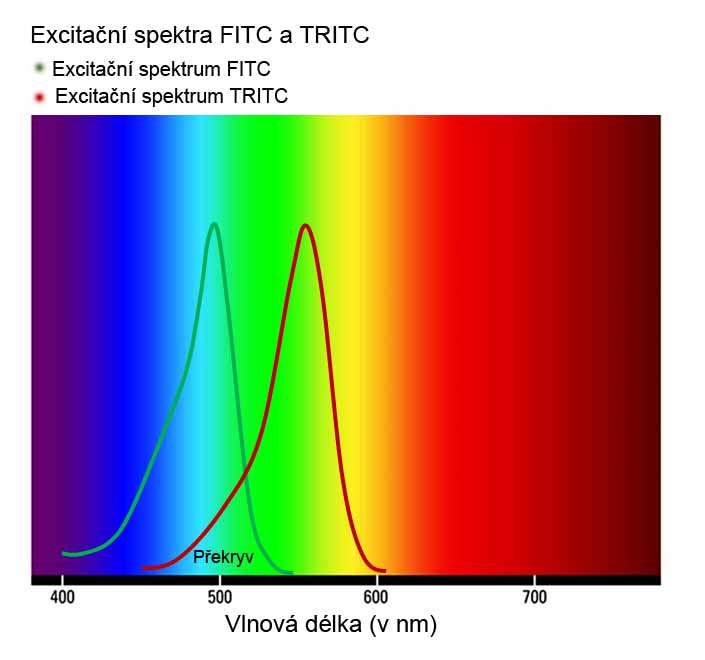
Překryv excitačního spektra. Fluorochromy nejsou excitovány jen vlnovou délkou z maxima svého excitačního spektra, ale také dalšími (delšími a kratšími) vlnovými délkami svého spektra, které mohou spadat do maxima excitačního spektra jiného fluorochromu. Např., k překryvu excitačního spektra dochází, pokud v experimentu použijeme FITC společně s TRITC. TRITC má maximum svého excitačního spektra při 550 nm, ale jeho excitační spektrum je v rozsahu 450 – 600 nm, které tak pokrývá i vlnovou délku pro excitaci FITC (vlnová délka excitačního maxima FITC je 495 nm). Při překryvu excitačního spektra tedy excitování jednoho fluorochromu přispívá k excitování druhého fluorochromu, a tím i jeho emisi. Při překryvu excitačních spekter je tedy ovlivňovaná intenzita emise druhého fluorochromu, nicméně specificita emitovaného spektra ovlivněná není (nevznikají falešné signály).
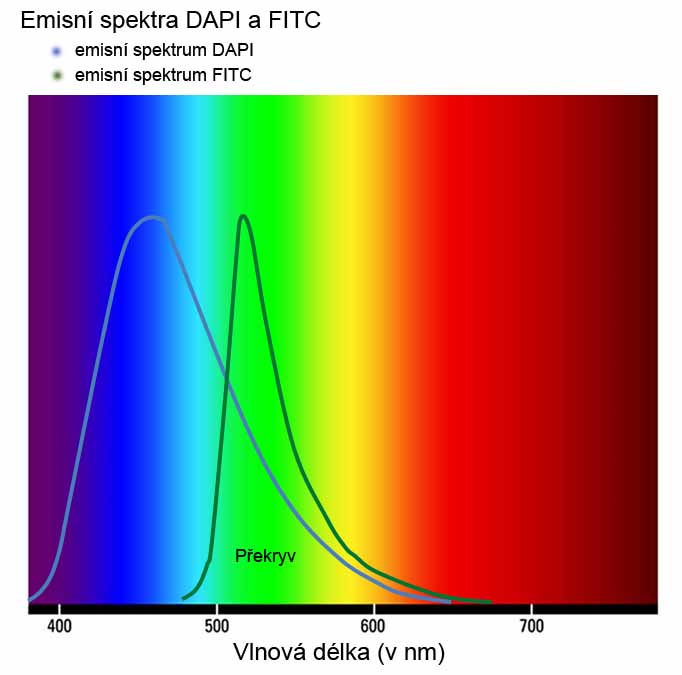
Překryv emisního spektra. Na základě překryvu emisního spektra se významná část emise z jednoho fluorochromu jeví jako emise z druhého fluorochromu. To vede k chybným interpretacím signálu, tzn. k falešným signálům, falešným kolokalizacím a může to být vážným důvodem k zásadně nesprávným experimentálním výstupům. Příkladem může být překryv emisního spektra DAPI (376 -650 nm) a FITC (480 – 674 nm), kdy se podstatná část emise z DAPI jeví jako emise z FITC (viz. obr. dole). Pro experimenty se simultánní detekcí dvou a více fluorochromů, je třeba kombinovat fluorochromy s optimálními spektry, v některých případech lze problém překryvu vyřešit i korekcí (oříznutím) emisního pásma. V případech, kdy překryvům nelze zabránit, je třeba jednotlivé fluorochromy snímat sekvenčně, tj. jeden po druhém.
KOMERČNÍ FLUOROCHROMY
Komerčně je dostupná celá řada fluorochromů o různých absorbčních a emisních vlnových délkách. K biologickému výzkumu jsou využívány fluorochromy, které se samy vážou na příslušné buněčné struktury (jako např. fluorochrom etidium bromid na molekulu DNA) nebo jsou fluorochromy konjugovány s nějakou molekulou, která má schopnost vazby na studovanou strukturu (např. protilátky). Fluorochromy jsou především organické látky, a to nejčastěji heterocyklické aromatické sloučeniny.
Literatura:
Lakowicz JR (2006) Principles of Fluorescence Spectroscopy. Third Edition, Springer.
Valeur B (2002) Molecular fluorescence: principles and applications. John Wiley and Sons.
Tsien RY, Waggoner A (1995) Fluorophores for confocal microscopy. In Pawley JB. Handbook of biological confocal microscopy. New York: Plenum Press. pp. 267–74. ISBN 0-306-44826-2.
https://www.chroma.com/
http://www.lifetechnologies.com/
http://www.piercenet.com/
