Molekulárním klonováním se rozumí namnožení úseku molekuly DNA z jedné kopie do obrovského kvanta kopií, a to prostřednictvím replikačního aparátu hostitelské buňky, např. bakterií či kvasinek. Klon je vlastně tak soubor molekul nebo buněk identických s původní molekulou nebo buňkou.
Technika klonování jednoduše znamená vložení klonovaného úseku DNA do hostitelské buňky, kultivaci a namnožení hostitelské buňky, tím namnožení vloženého úseku, a na závěr izolace klonované DNA z hostitelských buněk.
Molekulární klonování je využíváno k různým účelům, jako např. pro konstrukci chimérických genů, pro výrobu hybridizační sondy, pro expresi rekombinantních proteinů.
Jako hostitelské buňky se kvůli snadné kultivace a obrovské rychlosti množení používají především bakterie, a to bakterie Escherichia coli. V některých případech, kdy je potřeba množit velké molekuly cizí DNA v celku, se používají také kvasinky. Cizí DNA se vloží do již předem připravené molekuly DNA (tzv. klonovacího vektoru), která obsahuje všechny sekvence potřebné ke vstupu, přežití a množení v dané hostitelské buňce.
——————————————————————————————————————————–—————————————————————————————————––———————————————
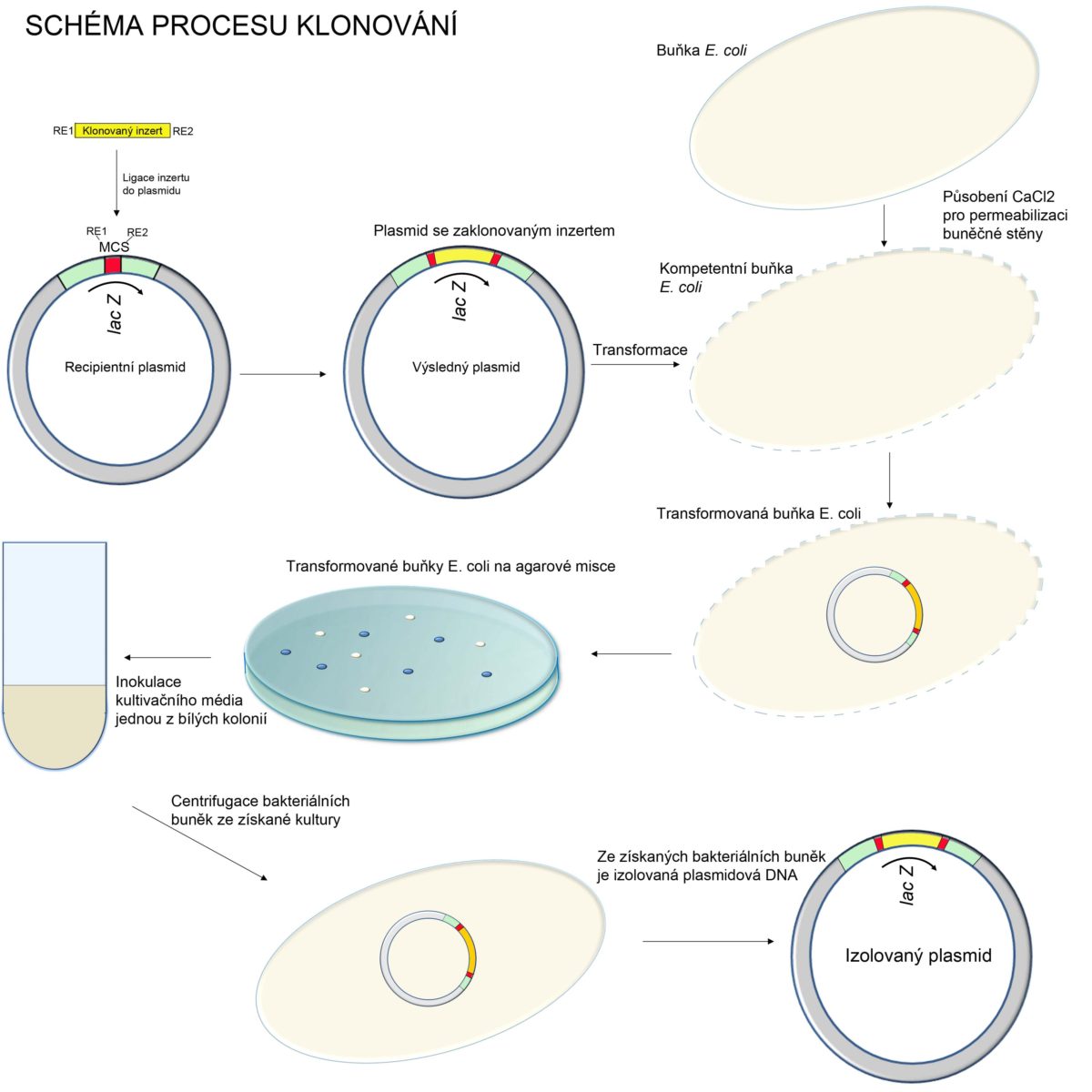
POSTUP PŘI KLONOVÁNÍ
Nejčastější postup při molekulárním klonování:
1. Výběr vhodného klonovacího vektoru (nejčastěji plasmidu)
2. Úprava konců vektorů a konců klonované DNA (inzertu) tak, aby konce byly vzájemně kompatibilní
3. Vložení DNA do vektoru
4. Vložení vektoru s inzertem do hostitelských bakteriálních buněk
5. Namnožení hostitelských buněk
6. Izolace plasmidové DNA s inzertem
——————————————————————————————————————————–—————————————————————————————————––———————————————
KLONOVACÍ VEKTORY
Správný klonovací vektor musí splňovat tři důležité vlastnosti:
• nese sekvence, které zajistí propagaci vektoru v hostitelské buňce, tj. nese geny k vlastní replikaci,
• nese tzv. klonovací místo tvořené řadou různých restrikčních míst, které po štěpení příslušnou restriktázou umožní inzerci klonovaného úseku DNA do vektoru,
• umožní selekci, která rozliší hostitelské buňky s vloženým vektorem od buněk bez vektoru nebo také buňky s vektorem obsahujícím inzert od buněk s prázdným vektorem.
Jako klonovací vektory se používají:
• plazmidy, což jsou malé kruhové molekuly DNA, které se v bakteriích přirozeně vyskytují a svou přítomností bakteriální buňce dodávají některé užitečné schopnosti (jako např. rezistenci k antibiotiku). K molekulárnímu klonování se používají geneticky modifikované plazmidy. Využití plazmidů pro molekulární klonování je vhodné, pokud klonovaná molekula DNA je relativně malá. Do plazmidu lze běžně vložit molekulu cizí DNA, jejíž velikost obvykle nepřesahuje 10 – 15 kb. Plasmidy rozlišujeme na několik typů. Nejčastěji jsou to plasmidy běžného klonovacího typu. Pak máme expresní vektory, které slouží k expresi proteinu ze zaklonovaného genu, a to pomocí silných regulačních oblastí (promotoru a enhanceru), které se ve vektoru nachází. Dalším typem plasmidových vektorů jsou tzv. “promoter probe“ vektory a „terminator probe“ vektory, tj. vektory, které slouží na testování promotorové a terminátorové aktivity.
• fasmidy (neboli také fagemidy) jsou v podstatě běžné bakteriální plazmidy, které nesou navíc části genomu některého bakteriofága. Obsahují jak počátek replikace ColE1, které zajišťují produkci dvouřetězcové plasmidové DNA, tak ale také obsahují počátek replikace vláknitého bakteriofága f1, který umožňuje připravit z fasmidu jednovláknovou DNA. Bakteriální buňka, která nese tento typ plasmidu, je infikována vhodným bakteriofágem. Bakteriofág, díky svému genu II, produkuje protein, který na plasmidu iniciuje replikaci formou valivé kružnice. Výsledkem této replikace jsou jednořetězcové molekuly plasmidové DNA, které jsou následně integrovány do nově vznikajících fágových partikulí. Tato jednořetězcová DNA je z těchto partikulí izolována a využita např. jako jednořetězcová sonda. Řada z běžně používaných plasmidových vektorů obsahuje f1 replikační místo a jsou to tedy vlastně fasmidy.
• kosmidy jsou modifikované plasmidové vektory, které byly vyvinuty pro klonování a uchovávání velkých fragmentů DNA. Kosmidové vektory umožňují klonování fragmentů až do 45 kb a obvykle jsou využívány k přípravě genomových knihoven. Hlavním rysem kosmidů je přítomnost tzv. cos-míst, dodaných z bakteriofága λ (lambda). Stejně jako tradiční plasmidy, kosmidy obsahují sekvence pro selekci bakterií pozitivních na přítomnost kosmidu (např. na základě rezistence vůči antibiotikům), obsahují počátek replikace (obvykle ColE1), které zajišťují replikaci kosmidu v hostitelské E. coli, a také nesou klonovací místa pro zaklonování cílové DNA. Rekombinantní molekula DNA (tj. kosmidová DNA nesoucí klonovaný inzert) je vnášena do fágových partikulí, přičemž dochází k rozštěpení cos-sekvencí ohraničující klonovaný inzert. Cos-sekvence jsou dlouhé cca 200 bp, obsahují tzv. cosN místo, kde pomocí enzymu terminázy dochází k rozštěpení na obou řetězcích, a to v místech, která jsou od sebe vzdálena 12 bp. Tímto štěpením dochází k linearizaci cirkulárního kosmidu, přičemž výsledná lineární molekula na svých koncích nese kohezivní konce dlouhé 12 bp (vzhledem k určité minimální velikosti vnášených molekul, jsou při produkci bakteriofágů vnášeny pouze kosmidy s inzertem). Vzniklé bakteriofágy jsou vneseny do vhodného kmene E. coli. Uvnitř bakteriální buňky jsou cos-sekvence spojeny, takže dochází k cirkularizaci vnesené molekuly, která se poté může množit jako standardní plasmid.
• bakteriofágy jsou viry, které napadají bakterie. Infikujeme-li hostitelský kmen bakterie bakteriofágem s vloženou cizí DNA, dojde v průběhu lytického cyklu k namnožení celé fágové DNA včetně cizí DNA. Pro molekulární klonování jsou využívány, pokud je klonována větší molekula DNA (40 – 50 kb).
• umělé bakteriální a kvasinkové chromosomy: molekuly cizí DNA větší než 47 kb lze zaklonovat do umělých bakteriálních nebo kvasinkových chromosomů. Obsahují sekvence, které zajistí replikaci celého umělého chromosomu v S-fázi buněčného cyklu hostitelské buňky, a dále sekvence, které plní funkci centromery při dělení hostitelských buněk v mitóze. Umělé kvasinkové chromosomy jsou lineární, takže jejich konce musejí být navíc chráněny před degradací telomerami.
——————————————————————————————————————————–—————————————————————————————————––———————————————
PLASMIDY JAKO KLONOVACÍ VEKTORY
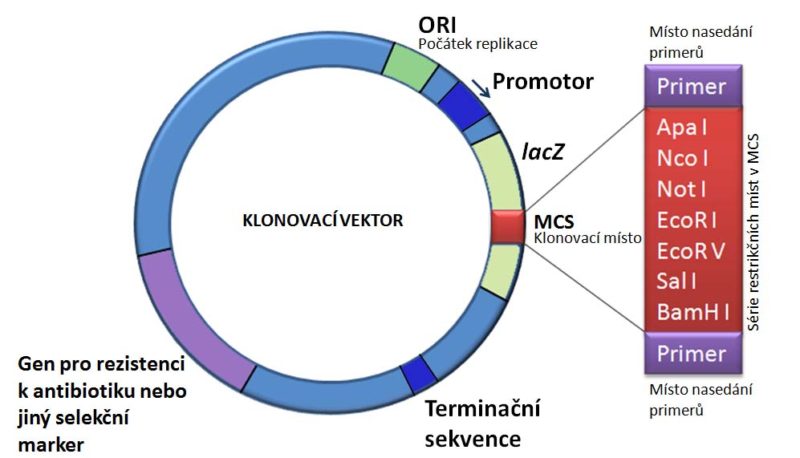
Plasmidy jsou cirkulární molekuly dvouřetězcové DNA, které jsou v bakteriích přirozeně přítomné. Jsou využívány pro experimentální manipulace s geny a klonování genů jako tzv. klonovací vektory. Ke klonování je komerčně dostupná celá řada klonovacích vektorů. Plasmidy používané jako klonovací vektory obsahují:
• replikátor (počátek replikace), tj. sekvenci, kterou rozpoznává DNA polymeráza hostitelské buňky,
• selekční marker, který zajistí buňkám obsahujícím vnesený vektor selekční výhodu nad buňkami, které vektor neobsahují. Jako selekční geny se nejčastěji používají geny pro rezistenci k antibiotiku, většinou ampicilinu, méně častěji kanamycinu, tetracyklinu, chloramfenikolu, aj.,
• klonovací místo (tzv. polylinker nebo MCS- multiple cloning site), tj. místo s velkým množství restrikčních míst, která umožní vložení cizí DNA),
• často také obsahují gen LacZ, který umožní tzv. modro-bílou selekci (viz. dále), umožňující rozlišení buněk obsahujících prázdný klonovací vektor od vektoru s vloženým inzertem.

——————————————————————————————————————————–—————————————————————————————————––———————————————
Klonování genu se děje v několika krocích:
1. LIGACE: Integrace genu do vektoru
2. TRANSFORMACE: Integrace vektoru do bakterií, tzv. transformací kompetentních buněk
3. KULTIVACE: Namnožení bakterií
4. IDENTIFIKACE KLONŮ: Identifikace klonů, které obsahují naši klonovanou DNA
5. IZOLACE PLASMIDOVÉ DNA: Izolace vektoru s naklonovanou DNA z bakterií
6. OVĚŘENÍ SEKVENCE KLONOVANÉ DNA: Restrikční štěpení a sekvenování
——————————————————————————————————————————–—————————————————————————————————––———————————————
INTEGRACE GENU DO VEKTORU
Existuje několik způsobů jak vložit DNA do vektoru.
• Metoda tradičního klonování (tzv. subklonování)
——————————————————————————————————————————–—————————————————————————————————––———————————————
LIGACE
Integrace inzertu do vektoru se provádí tzv. ligací. Ligace se děje prostřednictvím enzymu T4 DNA ligázy, která spojuje volné konce.
• Pro ligační reakci potřebujeme roztok s rozštěpeným klonovacím vektorem a roztok inzertu, který nese konce kompatibilní ke štěpeným koncům klonovacího vektoru. Dále se přidá ligační pufr, který obsahuje ATP a potřebné soli.
• Standardně se do ligační reakce dává cca 50 ng vektoru. Množství inzertu, které je do reakce třeba dodat, se odvíjí od velikosti inzertu, protože pro úspěšnou ligaci je do reakce třeba dodat vhodný poměr počtu konců vektoru k počtu konců inzertu, a to nejčastěji jako 3:1, 2:1 nebo 1:1 (vždy inzert ku vektoru). Potřebné množství inzertu tedy vypočteme následovně:
• Ligace se provádí obvykle po dobu 1 hodiny při teplotě 16 °C nebo přes noc při teplotě 4 °C.
Příklad:
Máme vektor o velikosti 3 kb a o koncentraci 50 ng/µl. Do tohoto vektoru chceme zaklonovat inzert o velikosti 800 bp (tj. 0,8 kb). Rozhodli jsme se udělat ligační reakci v poměru 3:1. Na ligační reakci použijeme klasicky 50 ng vektoru. Potřebné množství inzertu vypočteme dle:
Množství inzertu [ng] = (Množství vektoru [ng]) x velikost inzertu [kb])/velikost vektoru [kb]
V našem případě tedy, množství inzertu = (50 ng x 0,8 kb)/3 kb = 13 ng. Protože jsme se rozhodli ligaci dělat v poměru 3:1, násobíme výsledek 3x. Tj. množství inzertu, které na reakci potřebujeme, je 39 ng, tj. cca 40 ng.
Pro výpočet množství inzertu a vektoru můžete využít naší kalkulačku.
Reakce :
Směs lehce promícháme a krátce centrifugujeme. Inkubujeme buď přes noc při 4 °C nebo hodinu při 16 °C.
![]() Mějme na paměti, že ligáza je extrémně citlivá na mechanické poškození. Vyvarujte se proto dlouhého a nešetrného protřepávání či vortexování.
Mějme na paměti, že ligáza je extrémně citlivá na mechanické poškození. Vyvarujte se proto dlouhého a nešetrného protřepávání či vortexování.
Po ukončení ligace ligační směsí transformujeme bakteriální kompetentní buňky.
——————————————————————————————————————————–—————————————————————————————————––———————————————
TRANSFORMACE BAKTRIÍ – INTEGRACE VEKTORU DO BAKTERIÍ
Pro integraci plasmidů do bakterií je využívaná tzv. bakteriální kompetence, tj. přirozená schopnost bakterií pojmout cizorodou DNA. Obecně bakterie využívají pro vpravování cizorodé DNA tři různé způsoby, tj. konjugaci, transformaci a transdukci. Přirozená kompetence je vysoce regulovaná, nicméně za určitých podmínek může být bakteriální kompetence využívaná v metodách genového inženýrství, kdy se kompetence navozuje speciálními podmínkami. Jedná se především o využití transformace.
Pro transformaci se používají speciálně upravené bakteriální buňky, označované jako kompetentní buňky. Normálně jsou bakteriální buňky chráněny cytoplasmatickou membránou a buněčnou stěnou. Aby byly buňky kompetentní, jejich speciální kultivace umožní prostupnost jejich buněčné stěny. Prostupnost cytoplasmatické membrány se zajistí při samotné transformaci, a to nejčastěji mírným teplotním šokem (42 °C), který způsobí „vtažení“ plasmidové DNA do buněk, nebo elektroporací, kdy se elektrickým proudem v cytoplasmatické membráně vytváří póry, kterými poté plasmidová DNA prochází dovnitř. Efektivita transformace je ovšem za těchto uměle navozených podmínek velmi nízká a k transformaci dochází jen u zlomku buněk.
![]() Při manipulaci s kompetentními buňkami, musíme mít na paměti, že kompetentní buňky, vzhledem k poškození jejich buněčné stěny, jsou velmi náchylné na jakékoli mechanické dráždění. Tj. s kompetentními buňkami zacházíme velmi opatrně, nabíráme špičkou velmi pomalu, a pokud roztok s buňkami chceme promíchat, tak jen opatrným „poťukáváním“ prstem na zkumavku.
Při manipulaci s kompetentními buňkami, musíme mít na paměti, že kompetentní buňky, vzhledem k poškození jejich buněčné stěny, jsou velmi náchylné na jakékoli mechanické dráždění. Tj. s kompetentními buňkami zacházíme velmi opatrně, nabíráme špičkou velmi pomalu, a pokud roztok s buňkami chceme promíchat, tak jen opatrným „poťukáváním“ prstem na zkumavku.
Samotná transformace
Pro nejvyšší efektivitu transformace se postup při transformaci řídí dle typu kompetentních buněk, tj. návodem výrobce. Nicméně existují určitá běžná pravidla.
Při transformaci teplotním šokem se transformace obvykle provádí tak, že:
• K 50 μl kompetentních buněk přidáme 1 – 2 μl ligační reakce. Jemně promícháme, a to buď krouživým a pomalým pohybem špičky nebo lehkým poťukáním prstu na stěnu zkumavky.
• Směs inkubujeme na ledu, po cca 30 min provedeme krátký teplotní šok při 42 °C, kdy se naruší cytoplasmatická membrána a plasmidy se začínají integrovat dovnitř do buněk. Délka teplotního šoku se odvíjí od typu kompetentních buněk, nejčastěji se ovšem dělá 45 s, ale může být od 30 – 90 s (vždy specifikováno výrobcem buněk). Po uplynutí této doby zkumavku urychleně přeneseme na led, kde necháme inkubovat 2 min.
• K buňkám přidáme tekuté kultivační médium (500 μl LB média nebo SOC média, bez antibiotika) a inkubujeme při 37 °C (obvykle 1 hod) za intenzivního protřepávání (200 rpm) nejlépe v horizontální poloze, v této fázi dochází k regeneraci cytoplasmatické membrány a množení buněk.
• Roztok s buňkami naneseme na pevné kultivační médium v Petriho misce s příslušným antibiotikem(klonovací vektor proti tomuto antibiotiku nese gen rezistence), a pečlivě rozetřeme zahnutou skleněnou tyčinkou. Vzhledem k různé účinnosti ligace a transformace, buňky nanášíme v různém množství na více kultivačních misek, např. 10 μl na jednu misku, 100 μl na druhou misku a zbytek buněk naneseme na třetí misku.
• Buňky inkubujeme přes noc při 37 °C . Na Petriho miskách pak vyroste z jedné kompetentní buňky vždy jedna kolonie – jeden klon.
——————————————————————————————————————————–—————————————————————————————————––———————————————
SELEKCE
Selekce klonů, které obsahují klonovací vektor od klonů, které vektor nenesou: Klonovací vektory nesou gen pro rezistenci k určitému antibiotiku, takže na médiu, které obsahuje dané antibiotikum, rostou pouze ty buňky, které tento vektor obsahují.
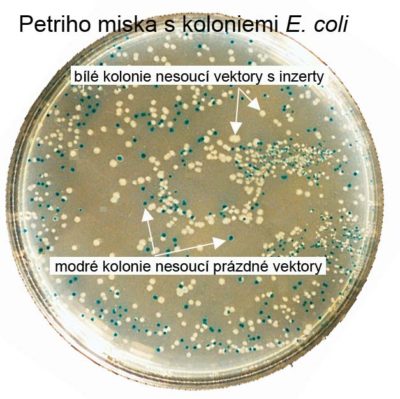 Selekce klonů, které obsahují klonovací vektor s inzertem od klonů, které obsahují prázdný klonovací vektor: Nejčastěji se používá tzv. modro-bílá selekce, kdy se využívá gen LacZ kódující enzym β-galaktosidázu.
Selekce klonů, které obsahují klonovací vektor s inzertem od klonů, které obsahují prázdný klonovací vektor: Nejčastěji se používá tzv. modro-bílá selekce, kdy se využívá gen LacZ kódující enzym β-galaktosidázu.
• β-galaktosidáza metabolizuje bezbarvou galaktozu X-Gal na 5-bromo-4-chloro-indoxyl, který dále spontánně oxiduje na modře zbarvený 5,5′-dibromo-4,4′-dichloro-indigo.
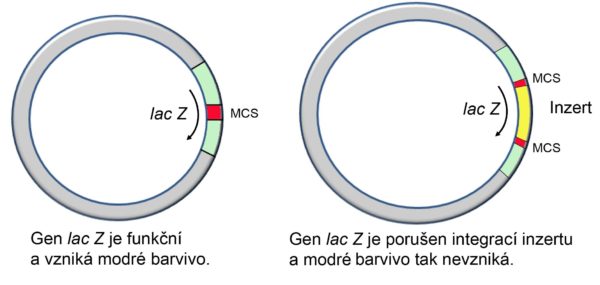
• V klonovacím vektoru, uvnitř genu LacZ, je umístěno klonovací místo. Přítomnost klonovacího místa nenarušuje funkčnost genu, nicméně funkčnost genu může být narušena integrací inzertu do tohoto místa, kdy dochází k porušení čtecího rámce genu LacZ.
• Pokud tedy pěstujeme bakterie na médiu obsahujícím X-Gal, modře zbarvené kolonie jsou kolonie buněk, jejich plasmid neobsahuje inzert, na rozdíl od bílých kolonií, jejichž plasmid inzert obsahuje.
• Tento systém je ovšem jenom pomocný, protože do určité míry selhává. Pomáhá nám ale zúžit soubor kolonií, které velmi pravděpodobně obsahují plasmid s vloženou DNA. Rovněž modro-bílou selekci nelze využít v případě subklonování.
• Pro skutečné ověření, že klony obsahují náš inzert, používáme PCR nebo restrikční štěpení.
——————————————————————————————————————————–—————————————————————————————————––———————————————
OVĚŘENÍ KLONŮ NESOUCÍCH INZERTNÍ DNA
To, jestli klon je specifický, tzn. jestli obsahuje naši DNA, můžeme ověřit třemi způsoby:
1. Nejjednodušším způsobem je tzv. klontest, což je PCR s primery, které jsou specifické pro klonovaný úsek DNA. Jako templátovou DNA používáme nepatrné množství testované kolonie, které se nabere špičkou a přenese přímo do PCR reakce. Pomocí tohoto testu můžeme poměrně rychle a levně identifikovat specifické kolonie, aniž bychom před tím museli pracně izolovat plasmidovou DNA pomocí „miniprepů“ (viz. níže).
2. Pokud již máme izolovanou plasmidovou DNA, specificitu ověřujeme pomocí restrikčního štěpení s vhodnou kombinací restriktáz, které štěpí v MCS vektoru. Toto štěpení nám po elektroforetické separaci umožní dle velikosti klonovacího vektoru a velikosti inzertu identifikovat, jestli klon obsahuje inzert či nikoliv.
3. Nejbezpečnějším způsobem ověření identity klonů je sekvenování.
V praxi se používají všechny tři způsoby, tj.:
1. V prvém kroku se pro prvotní identifikaci na několika koloniích provede klontest, což nám umožní určit alespoň několik specifických kolonií.
2. Ve druhém kroku se u několika z těchto specifických kolonií izoluje plasmidová DNA pomoci tzv. miniprepu. U této DNA se provede restrikční štěpení.
3. Ve třetím kroku se DNA osekvenuje. Sekvenování je buď s primery, které jsou specifické k sekvenci klonovacího vektoru, jako např. T3, T7, SP6, nebo s primery, které jsou specifické k inzertní DNA. Sekvenování nám jednak identifikuje orientaci inzertu (v některých experimentech je nutné mít inzert zaklonovaný v určité orientaci) a také ověří správnost sekvence zaklonovaného inzertu, což je důležité především v případech, kdy klonujeme PCR produkt, v jehož sekvenci vlivem nepřesnosti PCR mohou být záměny nukleotidů.
——————————————————————————————————————————–—————————————————————————————————––———————————————
DETAILNÍ POSTUP PŘI TRANSFORMACI A IDENTIFIKACI KLONŮ
Transformace může být prostřednictvím teplotního šoku nebo elektroporací. Obecné schéma transformace je velmi podobné, nicméně protokoly transformací u jednotlivých typů kompetentních buněk se mohou mírně lišit. Proto v konkrétních případech doporučujeme následovat instrukce dané výrobcem.
My uvedeme protokol pro transformaci buněk DH5α teplotním šokem:
1. Kompetentní buňky vyndáme z -80 0C. Rozehřejeme buď umístěním na led, nebo opatrně v ruce. Buňky se ale nesmí zahřát příliš! Rovněž s buňkami, protože mají poškozenou buněčnou stěnu, zacházíme velmi opatrně – netřeseme s nimi, nevortexujeme, necentrifugujeme. Pokud promícháváme, tak špičkou jejím opatrným kroužením.
2. K 50 µl buněk přidáme 2 µl ligační směsi, jemně promícháme (až 25 ng DNA na 50 μl buněk, objem DNA nesmí přesáhnout 5% objemu kompetentních buněk).
3. Inkubujeme 30 minut na ledu. Občas zlehka promícháme.
4. Provedeme teplotní šok umístěním zkumavky s buňkami na 90 sekund do 42 °C.
5. Zkumavku rychle přemístíme na led a inkubujeme 1 – 2 minuty.
6. K buňkám přidáme 800 – 900 μl SOC media nebo LB media.
7. Inkubujeme na třepačce 45 – 60 minut při 37 °C.
8. Připravíme kultivační misky s LB/Amp/IPTG/X-Gal:
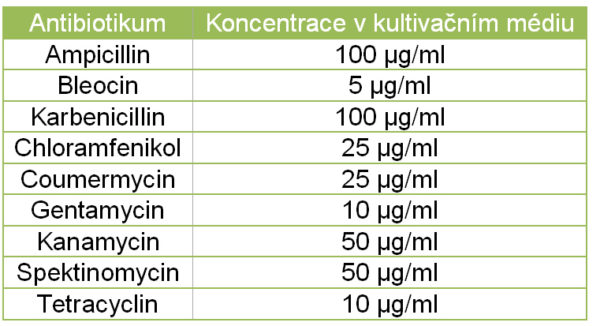
• K rozehřátému pevnému LB médiu, jehož teplota není vyšší než 65 °C (jinak by degradoval ampicilin), přidáme ze zásobního roztoku ampicilin do finální koncentrace 100 µg/ml kultivačního média. Pokud máme 0,1 g/ml zásobní roztok ampicilinu, na jeden mililitr média přidáváme 1 µl ampicilinu. Médium rozlijeme do misek (cca 25 ml do Petriho misky o průměru 8 cm).
• V 1,5 ml sterilní zkumavce smísíme 64 µl X-Gal (12,5 mg/ml) a 3,5 µl IPTG (240 mg/ml) ze zásobního roztoku, promícháme a naneseme na povrch pevného média a pomocí sterilní skleněné kultivační kličky rovnoměrně rozetřeme po povrchu média. Sterilitu získáme namočením kličky do etanolu a jejím krátkým vypálením nad plamenem.
9. 100 μl buněk rozetřeme sterilní skleněnou kličkou na povrch media.
10. Zbytek buněk centrifugujeme, většinu supernatantu tj. horní fáze odstraníme a ve zbytku supernatantu (cca 100 µl) resuspendujeme buňky. V této fázi buňky již mají obnovenou buněčnou stěnu, takže nejsou náchylné k mechanickému poškození. Buňky naneseme na médium.
11. Inkubujeme misky s buňkami přes noc v 37 0C. Obvykle je inkubační doba 12 – 16 hodin, ne výrazně více, jinak bakterie přerostou.
IDENTIFIKACE KLONŮ
Bílé kolonie, které nám narostly, sterilní špičkou či párátkem přeneseme („přečárkujeme“) na misku s čerstvým médiem a necháme růst alespoň několik hodin nebo lépe přes noc.
Provedeme klontest pro identifikaci specifických kolonií. Tzn. malé, téměř nepatrné množství kolonie přeneseme špičkou do PCR reakce, která obsahuje primery specifické pro náš zaklonovaný fragment. Provedeme PCR za standardních podmínek a vyhodnotíme elektroforeticky. Tento test nám určí, které z bílých kolonií skutečně nesou náš klonovaný fragment.
——————————————————————————————————————————–—————————————————————————————————––———————————————
IZOLACE PLASMIDOVÉ DNA
Pro izolaci plasmidové DNA používáme komerční kity, kterých je na trhu celá řada, přičemž je dodržován postup dle protokolu dodaného výrobcem.
• Izolace plasmidové DNA se obvykle provádí ve čtyřech různých objemech. Děláme tzv. izolaci miniprepů (pokud je izolováno jen malé množství plasmidové DNA), midiprepů (střední množství), maxiprepů (velké množství) a megaprepů (enormně velké množství).
• V počátečních fázích klonování, kdy ještě nemáme ověřenou správnost zaklonovaného konstruktu, používáme izolaci miniprepů. Větší množství plasmidu izolujeme až ve chvíli, kdy máme bezpečně ověřenou sekvenci zaklonovaného fragmentu a potřebujeme velké množství plasmidu pro uskladnění či další experimenty.
Příprava bakteriální kultury:
• Prvním krokem při izolaci plasmidové DNA je inokulace (tj. naočkováním) tekutého kultivačního média klonem bakterií. Nejčastěji je využíváno LB médium (Luria broth). Důležitou součástí tohoto kroku je přídavek vhodného antibiotika do kultivačního média, které zajistí, že v médiu vyrostou pouze ty bakteriální buňky, které vůči tomuto antibiotiku nesou rezistenci, tzn., že vyrostou pouze bakteriální buňky nesoucí plasmid, který obsahuje gen pro danou rezistenci. Výběr antibiotika, které do média přidáme, je tedy dán genem pro rezistenci k danému antibiotiku, který náš plasmid obsahuje.
• Množství kultivačního média, které pro inokulaci použijeme, se odvíjí od množství, ve kterém plasmidy izolujeme, stejně tak se může objem média lišit mezi různými izolačními kity. V případě izolace miniprepů je obvykle objem kultivačního média 3 – 5 ml.
• Kultivační médium nalijeme do nejlépe plastové zkumavky (v případě izolace miniprepů postačí 50 ml plastová Falconova zkumavka). Pokud izolujeme plasmidy ve větším množství, jsou obvykle využívány Erlenmayerovy baňky. Vždy platí zásada, že objem nádoby by měl být alespoň 4x větší než je objem kultivačního média. Do média přidáme vhodné antibiotikum, viz. tabulka.
• Do připraveného média naneseme vybranou bakteriální kolonii a to tak, že koncem sterilní špičky či koncem sterilního párátka kolonii nabereme a špičku/párátko vhodíme do připravené nádoby s kultivačním médiem.
• Takto připravenou kulturu necháme inkubovat při 37 °C 12 – 18 hodin za neustálého třepání. Pro zdárný růst bakterií je třeba médium dobře prokysličovat, čili by rychlost promíchávání měla být poměrně vysoká, a to okolo 200 rpm. Zvýšením rychlosti protřepávání až ke 400 rpm lze růst bakterií ještě zintenzivnit.
• Správně narostlá kultura, která je patrná dle denzity buněk v médiu, je následně využita pro samotnou izolaci plasmidové DNA.
• Plasmidovou DNA, kterou skladujeme v -20 0C můžeme kdykoliv použít pro zpětnou transformaci a izolaci nové plasmidové DNA.
——————————————————————————————————————————–—————————————————————————————————––———————————————
RESTRIKČNÍ ŠTĚPENÍ PLASMIDU
Pomocí restrikčního štěpení můžeme jednak identifikovat specifické klony nesoucí zaklonovaný inzert, jednak ho používáme pro vyštěpování určitých úseků v zaklonované DNA či vkládání nových úseků do zaklonované DNA, tj. pro konstrukci chimérické DNA. Restrikční štěpení plasmidové DNA se provádí za standardních podmínek.
Důležitá pravidla pro restrikční štěpení při klonování:
• Pro štěpení vybíráme restrikční enzymy, které štěpí pouze v MCS daného vektoru. Přítomnost restrikčního místa zkontrolujeme také v klonovaném inzertu. Restrikční místo by mělo být obsaženo jen v místě, které chceme štěpit, tedy ne nikde jinde v inzertu.
• Preferenčně pro štěpení využíváme dva různé restrikční enzymy. V případě použití jen jednoho druhu restriktázy dojde při ligaci preferenčně k recirkularizaci vektoru, tj. spojení konců vektoru, aniž by byl inzert integrován.
• Pokud není zbytí a je využit ke štěpení jen jeden druh restriktázy, pro zabránění recirkularizace vektoru, je vektor na svých 5’ koncích defosforylován. K této defosforylaci se standardně používá CIP (calf intestinal phosphatase) nebo SAP (shrimp alkaline phosphatase). Podmínky defosforylace uvádí vždy výrobce dané fosfatázy.
Pokud máte ve vašem vektoru problém najít vhodná restrikční místa, existuje několik možností, jak to vyřešit:
– najít jiný vhodnější vektor
– vhodná místa ve vektoru vytvořit oligo klonováním nebo vhodná místa naopak vytvořit na koncích klonovaného inzertu pomocí PCR klonování
– vytvořit tupé konce jak na vektoru, tak na inzertu. K tomu je využívaná T4 DNA polymeráza nebo enzym Klenowův fragment, které doplní 5’ převisy a 3’ převisy odstraní.
Zkontrolujte, zda restrikční endonukleáza, kterou plánujete použít, není citlivá k Dam nebo Dcm metylaci. Plasmidy, které jsou připravovány v bakteriálních kmenech, které obsahují Dam nebo Dcm metylační aktivitu, budou rezistentní ke štěpení v místech, která jsou metylována. V případě Dam metylace se jedná o metylaci v pozici N6 adeninu v sekvenci GATC a v případě Dcm metylace je to metylace v pozici C5 druhého cytosinu v sekvenci CCAGG a CCTGG. Pokud využíváte takovéto enzymy, je třeba plasmidy transformovat do kmenů E. coli, které tuto metylační aktivitu postrádají. Jsou to tzv. dam–/dcm– kompetentních buňky.
V některých případech se při štěpení projeví tzv. Star aktivita. Star aktivita znamená, že enzym štěpí v sice podobné, ale ne identické sekvenci, v jaké by měl správně štěpit. Star aktivita může být způsobena velkou koncentrací enzymu, dlouhou inkubační dobou při štěpení nebo také vysokou koncentrací glycerolu.
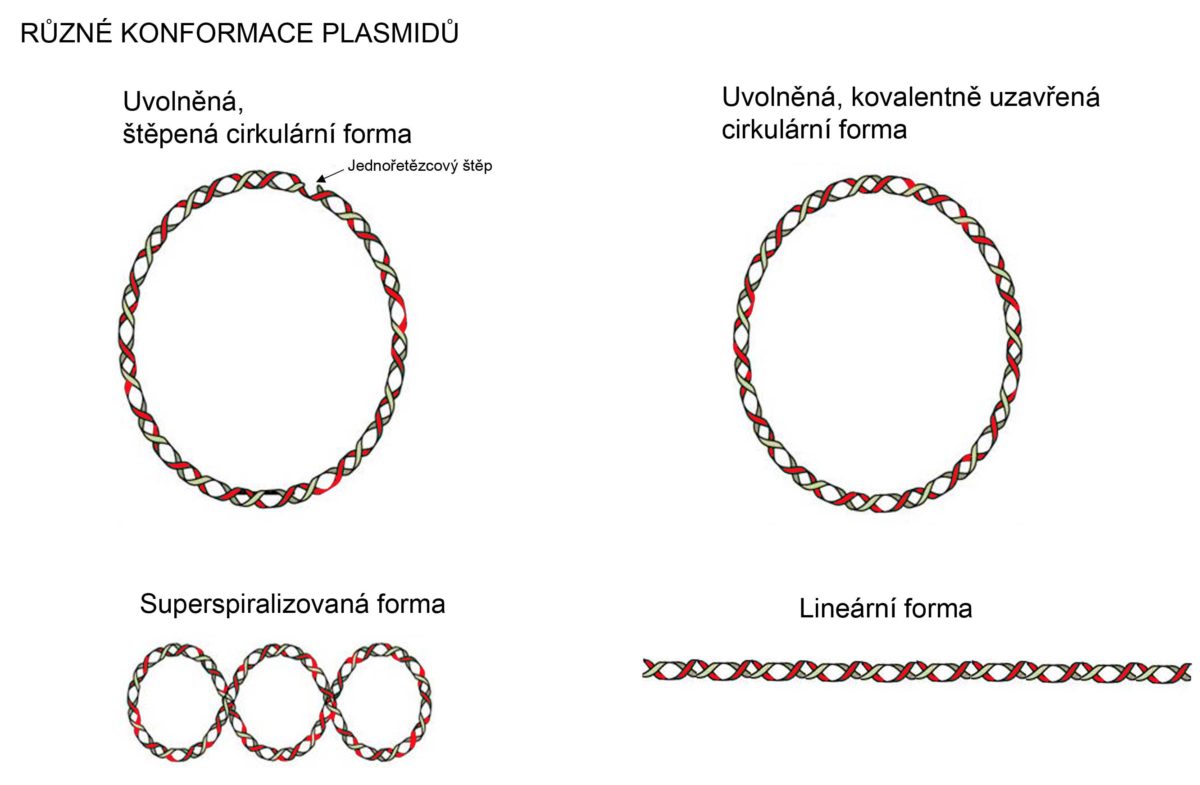
Konformace plasmidové DNA
Plasmidová DNA se vyskytuje v jedné z pěti různých konformací. Typ konformace ovlivňuje elektroforetickou mobilitu této DNA. Elektroforetická mobilita je od nejnižší po nejvyšší pokud plasmidová DNA je:
- Štěpená, otevřená cirkulární forma: štěp v jednom z řetězců DNA.
- Uvolněná cirkulární forma: oba řetězce DNA jsou neštěpené, k relaxaci dochází enzymaticky.
- Lineární forma: linearizovaná forma rozštěpením obou řetězců.
- Superspiralizovaná forma: vzniká stočením neštěpené, kruhové molekuly.
- Superspiralizovaná denaturovaná forma: Jedná se o spiralizovanou formu, která je ale méně kompaktní tím, že některé oblasti molekuly jsou nespárovány.
——————————————————————————————————————————–—————————————————————————————————––———————————————
SEKVENOVÁNÍ ZAKLONOVANÉHO ÚSEKU DNA
Pro sekvenování se často používají primery, které jsou specifické k sekvencím ohraničujícím klonovací místo. U velké části klonovacích vektorů to jsou primery T3, T7 nebo SP6.
——————————————————————————————————————————–—————————————————————————————————––———————————————
Literatura:
Green M., Sambook J. (2012) Molecular Cloning: A Laboratory Manual. Cold Spring Laboratory Press. 4 vydání. ISBN-10: 1936113422
Sambrook J., Fritsch E.F., Maniatis T. (1989) Molecular Cloning: A Laboratory Manual. 2 vydání. Cold Spring Harbor Laboratory. ISBN-13: 978-0879693091
www.addgene.org


